
晚期胃癌整体预后不佳,传统化疗药物进入瓶颈期,靶向药物选择有限,免疫治疗单药疗效不佳。精准医学时代,面临胃癌的高度异质性、晚期胃癌药物精准治疗的困境和新型抗肿瘤药物挖掘,应积极鼓励患者参加临床研究。
一线治疗
氟尿嘧啶类、铂类和紫杉类药物是晚期胃癌的主要化疗药物。通常一线化疗方案以氟尿嘧啶类药物为基础,联合铂类和/或紫杉类药物组成两药或三药化疗方案。在我国,更多推荐氟尿嘧啶类和铂类药物的两药联合方案,因患者更好的耐受性和我国真实世界临床治疗应用现状,铂类药物更多推荐奥沙利铂。Ⅲ期临床研究SOX-GC比较SOX和SP一线治疗弥漫型或混合性晚期胃/食管胃交界处腺癌的疗效,结果显示,对比SP方案,SOX方案在一定程度上可提高有效率和改善患者生存,具有更好的耐受性,3级或以上不良事件,如中性粒细胞减少、贫血、恶心、呕吐、厌食等发生率均明显低于SP组(神经感觉毒性除外),推荐非肠型胃癌首选SOX",紫杉类药物联合氟尿嘧啶类药在临床研究和临床实践中显示充分的疗效和安全性",三药方案DCF虽然在Ⅲ期研究中达到了研究终点,但较高的毒性限制了它的临床运用",mDCF或POF方案在随机研究中证实疗效优于两药方案,且耐受性尚可。但一项Ⅲ期研究显示替吉奥+顺铂基础上加用多西紫杉醇并未见生存获益。一项Ⅱ期研究结果显示多西紫杉醇+奥沙利铂+5-FU的有效率和生存时间优于多西紫杉醇+奥沙利铂或多西紫杉醇+奥沙利铂+卡培他滨,化疗方案的选择应依据患者年龄、体能状况、伴随疾病、既往治疗情况、患者意愿、经济状况、临床实践偏向、药物可及性等综合考虑。
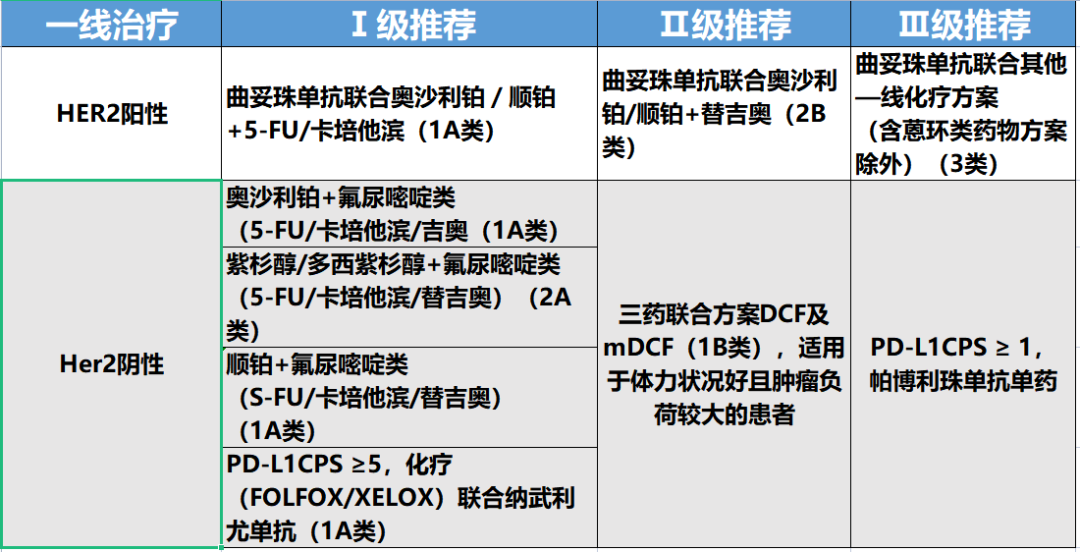
目前无充分证据推荐根据分子分型、体外药敏试验、移植瘤模型、药物代谢酶学或者代谢组学等进行化疗疗效预测,选择化疗药物及配伍方案。氟尿嘧啶类药物可疑代谢障碍者,可行DPD酶检测。伊立替康可疑代谢障碍者,可行UGTIA1基因多态性检测。
晚期胃癌标准治疗持续时间4-6个月,取得疾病控制后定期复查。一项Ⅲ期随机对照研究显示,紫杉醇联合卡培他滨4个周期后序贯卡培他滨单药维持治疗较顺铂联合卡培他滨6个周期未能延长总生存期,但显著改善生活质量及治疗相关不良反应。
有研究表明,年老或体弱患者减量的两药方案优于单药方案。GO2研究将年老或体弱患者随机分配到以下3种剂量级别:A级别,奥沙利铂130mg/m2+卡培他滨625mg/m2(每日2次),21d重复;B级别剂量为A级别的80%;C级别剂量为A级别的60%,结果C级别不仅生存时间不劣于A或B级别,而且患者体验最佳(总体治疗效用、毒性和生活质量)。
二线治疗
目前,关于胃癌二线化疗Ⅲ期研究均采取单药治 疗,但有小样本Ⅱ期研究结果显示,对于PS=0~1分患者,双药化疗安全性可且带来更好的肿瘤控制,因此,对于体力状况较好的患者,经充分衡量治疗利弊后,可考虑联合化行。日本ABSOUTE Ⅲ期研究显示,每周白蛋白紫杉醇方案在总生存时间方面不劣于每周溶剂型紫杉醇,白蛋自紫杉醇组中性粒细胞减少和食欲下降更常见,但超敏反应发生率较低。
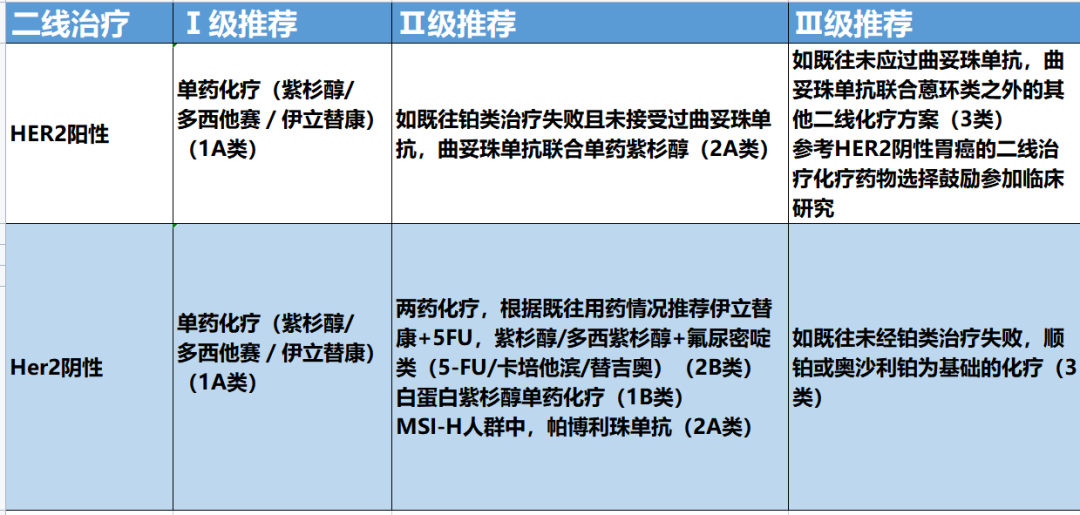
三线及三线以上治疗(不分HER2阳性或阴性)
晚期胃癌三线化疗仅涉及小样本研究,化疗获益不明确,在临床实践中,特别强调根据患者体力状况、基础疾病、肿瘤相关症状和并发症风险,衡量治疗风险和利益,综合考虑。

TOGA研究结果显示,对初治HER2阳性的晚期转移性胃腺癌患者,曲妥珠单抗联合S-FU/卡培他滨+顺铂较单纯化疗提高有效率和增加生存获益。多项Ⅱ期临床研究评估了曲妥珠单抗与其他化疗方案的联合,显示较好的疗效和安全性。前瞻性的真实世界研究EVIDENCE旨在评价曲妥珠单抗在HER2阳性转移牲胃癌中国患者中的有效性、安全性、治疗模式和临床结局,纳入1600例患者,进一步证实中国人群曲妥珠单抗的疗效与良好安全性,一线治疗联合化疗方案中,与XELOX疗效最佳,OS达34.6个月,一线化疗进展后的HER2阳性晚期胃癌患者,如既往未接受曲妥珠单抗,Ⅱ期临床研究显示了紫杉醇联合曲妥珠单抗的疗效和安全性。若既往接受曲妥珠单抗治疗失败,近年国内外的Ⅱ期研究和回顾性研究结果显示曲妥珠单抗跨线治疗价值存在争议,缺乏高级别循证医学依据,2020年《中国生物类似药专家共识》认可生物类似药的临床替代。2020年8月NMPA批准曲妥珠单抗生物类似物汉曲优的适应证包括HER2阳性乳腺癌,以及联合卡培他滨或5-FU和顺铂适用于初治转移性HER2阳性转移性胃癌。
其他以HER2为靶点的药物有帕妥珠单抗(抗HER2单克隆抗体,JACOB研究)、拉帕替尼(小分子酪氨酸激酶抑制剂,TyTAN研究和LOGIC研究),尽管抗体偶联药物(antibody drug conjugate,ADC)TDM-1(曲妥珠单抗DM偶联物)在胃癌二线治疗的Ⅲ期研究结果为阴性",针对HER2的ADCS继续受到关注,Ⅱ期研究结果显示DS-8201(曲妥珠单抗-trastuzumal derutecan)和RC48-ADC(抗HER2单抗-MMAE偶联剂)针对曲妥珠单抗治疗失败的晚期HER2阳性胃癌患者有良好的肿瘤缓解率和生存获益。
针对晚期胃癌获批的抗血管生成药物包括雷莫芦单抗(抗VEGFR2单克隆抗)、甲磺酸阿帕替尼(VEGIFR-2小分子酪氨酸激酶抑制剂),对于一线含铂类和/或氟尿嘧啶类化疗后进展的转移性胃/食管胃结合部腺癌,REGARD研究显示,雷莫芦单抗单药二线治疗相比安慰剂延长mos(5.2个月vs 3.8个月,P-0.0473);RAINBOW研究显示,雷莫芦单抗联合紫杉酵二线治疗相比紫杉醇延长mOs(9.63个月vs,7.36个月,P=0.0169),不良反应均可耐受。雷莫芦单抗单药或联合紫杉醇已被FDA批准用于晚期胃癌的二线治疗。Ⅲ期临床研究纳入二线及以上化疗失败的胃癌患者273例,结果显示甲磺酸阿帕替尼治疗组较安慰剂组延长中位PFS(2.6个月vs 1.8个月,P=0.016)和提高疾病控制率(42.05% vs 8.79%,P<0.001),甲磺酸阿帕替尼被批准用于晚期胃或食管胃结合部腺癌患者的三线及三线以上治疗。CscO抗肿繼药物安全管理专家委员会组织制定了《甲磺酸阿帕替尼临床应用专家共识》,提供给临床医师,作为合理安全用药参考。
基于前瞻性临床研究结果,免疫检查点抑制剂已先后在全球范围内获批用于胃癌的三线治疗。针对亚洲人群的ATTRACTION-02研究结果显示,纳武利尤单抗三线治疗复发或转移性胃或食管胃结合部腺癌,与安慰剂相比,患者死亡风险显著降低,两组1年总生存率分别为26.2%和10.9%,2020年ASCO GI更新了3年随访数据,显示生存持续获益。2020年3月中国国家药品监督管理局(NMPA)批准纳武利尤单抗用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或食管胃交界腺癌患者。KEYNOTE-059研究结果显示,帕博利珠单抗三线治疗PD-L1 CPS ≥1的复发或转移性胃或食管胃结合部腺癌,Os 6个月,ORR 12%,目前多个国产PD-1抗体在标准化疗失败的晚期胃癌中开展临床研究,ORR10%-20%,安全性可控。
结论
在胃癌免疫治疗的二线治疗中,一项临床研究纳入包含胃癌在内的11种常规治疗失败的dMMR/MSI-H恶性肿瘤,接受帕博利珠单抗治疗,ORR为53%,CR 21%,常规治疗失败的MSI-H/dMMR胃癌患者为接受免疫治疗的获益人群。KEYNOTE-061研究结果显示与标准化疗紫杉醇相比,帕博利珠单抗单药二线治疗未显著改善PD-LI CPS ≥1患者的总生存期。尽管后续标志物分析显示TMB及PD-L1 CPS评分与帕博利珠单抗受益相关,免疫检查点抑制剂在晚期胃癌二线治疗地位尚未确立,不推荐在临床实践中常规单独或联合应用,鼓励患者参加相关的临床研究。
胃癌一线免疫治疗策略,包括PD-1单抗单药或联合化疗。从联合治疗来看,目前共有3项大型Ⅲ期随机对照研究对比了PD1单抗联合化疗与单纯化疗。DKEYNOTE-062 36结果显示在PD-LI CPS > 1患者中,化疗(卡培他滨或5-FU+顺铂)联合帕博利珠单抗对比单纯化疗未显著延长胃癌患者生存。②CheckMate-649研究显示,在PD-L1 CPS ≥5的主要终点人中,纳武利尤单抗联合化疗(FOLFOX或XELOX)较单纯化疗的OS更优(mOS为14.1个月vs 11.1个月,HR 0.71,P<0.000 1),在CPS ≥ 1和所有随机患者的次要终点人群中也可以显示生存获益。联合治疗在CPS ≥ 1和所有随机患者中均可带来PFS的获益趋势,且在CPS ≥5 患者中具有统计学意义(mPFS为7.7个月vs 6.0个月,HR 0.68,P<0.000 1)。因此,推荐在PD-LI CPS ≥5的晚期胃癌一线治疗中,推荐纳武利尤单抗联合FOLFOX/XELOX,③亚洲研究ATTRACTION-4 未以PD-L1表达作为入组筛选标准,在全人群中,纳武利尤单抗联合(sOX或XELOX)较单纯化疗,PFS显著改善,分别为10.45个月vs 8.34个月(HR 0.68),联合治疗的ORR显著高于化疗组(57.5% vs 47.8%,P=0.0088),反应持续时间(DOR)为12.91个月(95%C1 9.89-16.56)vs 8.67个月(95%CI 7.20-11.37),但二者Os相近,分别为17.45个月vs.17.15个月(HR 0.90),且入组人群中仅有约5%为中国台湾人群,对于PD-LI未知患者,暂不推荐常规联合PD-1单抗治疗。
胃癌一线免疫治疗单药的研究中,KEYNOTE-059队列3显示,在PD-LI CPS ≥ 1患者中,帕博利珠单抗单药ORR 26%,DCR 36%,mPFS 3.3个月,但mOS可达20.7个月;Ⅲ期研究KEYNOTE-062显示,对PD-LI CPS > 1 患者,帕博利珠单抗Os非劣效于化疗(10.6个月 vs 11.1个月),但两条生存曲线存在交叉,尚须考虑超进展等风险,目前建议仅在患者存在化疗禁忌证或拒绝化疗时进行考虑,同时尽量维持患者体力状况及营养功能;在MSI-H亚组中,帕博利珠单抗组的ORR为57.1%,OS未达到(10.7-NR),较单纯化疗明显为优(仅36.8%及8.5个月),另外,亚洲亚组数据显示,对于CPS ≥1和CPS ≥10的患者,帕博利珠单抗单药治疗较化疗有更长的生存优势,OS分别为22.7个月vs.13.8个月,和28.5个月vs.14.8个月。由于帕博利珠单抗单药应用的超进展风险等尚缺乏充分数据,故在PD-LI CPS ≥1患者的一线治疗中目前不常规推荐免疫治疗单药,但如存在化疗禁忌时可考虑应用帕博利珠单抗单药;在MSI-H患者中,帕博利珠单抗较化疗存在明显生存获益,故不推荐在此类人群中单纯化疗。
目前,dMMR/MSI-H是公认的胃癌免疫治疗疗效预测标志物,FDA批准帕博利珠单抗和纳武利尤单抗用于所有具有高度微卫星不稳定性(MSIL-H)或者错配修复缺陷(dMMR)实体瘤患者的二线或三线治疗。除上述临床研究以PD-L1 CPS评分作为筛选入组条件外,KN061研究中亦显示,PD-L1 CPS ≥1分,5分及10分患者,帕博利珠单抗较紫杉醇单药延长Os分别为0.8个月,1.9个月及2.4个月,PD-LI CPS评分与疗效相关,此相关性在Checkmate649化疗免疫联合治疗也得以确认。KN061研究同时显示组织肿瘤突变负荷(TMB)高者接受帕博利珠单抗较紫杉醇化疗ORR,PFS及OS均明显为优;在特瑞普利单抗治疗难治性胃癌的中国Ⅱ期研究纳入58例患者,也显示高TMB患者(≥12muts/Mb)的ORR(33.3%对7.1%,P=0.017)及OS(14.6个月vs 4.0个月,P=0.038)均明显优于低TMB患者(12muts/Mb)。
韩国一项帕博利珠单抗单药治疗标准治疗失败的胃或胃食管腺癌患者的Ⅱ期临床研究显示,61名患者中6名为EB病毒感染阳性者,ORR为100%,EBV感染可能是PDI单抗获益的标志物。但中国人群的两项观察性研究显示,EBV阳性胃癌患者一线治疗失败接受免疫检查点抑制剂有效率为33.3%,因此EBV感染是否是关键性标志物尚需在前瞻性研究中进行验证。
数项Ⅱ期研究显示HER2阳性胃癌患者联合抗HER2治疗与免疫检查点抑制剂、免疫检查抑制剂联合抗血管生成等可能成为有潜力的联合策略,如曲妥珠单抗联合帕博利珠单抗及XELOX一线治疗晚期胃癌(NCTO3615326,CTR20182551),卡瑞利珠单抗联合XELOX方案序贯卡瑞利珠单抗联合阿帕替尼一线治疗胃/胃食管交界处癌,目前正在进行Ⅲ期临床研究(NCTO3813784,CTR 20200660),暂不推荐在临床实践中常规进行。
-----------END--------------

主要文献:
[1] KANG YK, KANG WK, SHIN DB, et al. Capecitabine/cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in patients with advanced gastric cancer: a randomised phase IIInoninferiority trial. Anr Oncol, 2009, 20 (4): 666-673.
「2] KOUZUMI W, NARAHARA H, HARA T, et al. S-1 plus cisplatin versus S-1 alone for first-line treat-ment of advanced gastric cancer (SPIRITS trial): a phase Il trial. Lancet Oncol, 2008, 9: 215-221.
[3] AL-BATRAN SE. HARTMANN JT, PROBST S, et al. Phase Il trial in metastatic gastroesophageal adeno-carcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: a study of the Arbeits-gemeinschaft Internistische Onkologie. J Clin Oncol, 2008, 26 (9): 1435-1442.
[4] LUO HY, XU RH. WANG F, et al. Phase II trial of XELOX as first-line treatment for patients with advanced gastric cancer. Chemotherapy, 2010, 56 (2): 94-100.
声明:本文由肿瘤学院作者整理,如有侵权请联系删除,转载需授权。













