组织学病理检测标本包括粗针穿刺活检标本、真空辅助微创活检标本、乳腺肿物切除标本、保乳切除标本、全乳切除标本(包括单纯切除术和改良根治术)、前哨淋巴结活检标本及腋窝淋巴结标本。
浸润性乳腺癌的病理报告应包括与患者治疗和预后相关的所有内容,如肿瘤大小、组织学类型、组织学分级、有无脉管侵犯、有无合并原位癌、切缘和淋巴结情况等。若手术前接受过全身治疗,则应对治疗反应进行评估。导管原位癌的病理诊断应报告核级别、有无坏死及手术情况。保乳标本的评价应包括显微镜检查中肿瘤距切缘最近处的距离,若切缘阳性,应注明切缘处肿瘤的类型。
浸润性癌和原位癌混合存在时,需明确浸润灶的范围、浸润灶最大径。HER-2检测应当对所有乳腺浸润性癌进行HER-2状态检测。HER-2的检测须在资质良好的病理实验室进行免疫组织化学(IHC)检测或原位杂交(ISH)检测。复发转移性乳腺癌患者,应尽量再检测HER-2,以明确转移灶HER-2状态。特别是病情发展不符合HER-2状态特点,更应重新检测HER-2状态。
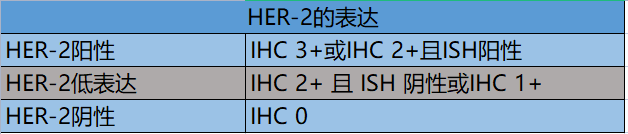
HER-2阳性定义:免疫组化结果为3+或ISH阳性。具体判读方法如下。
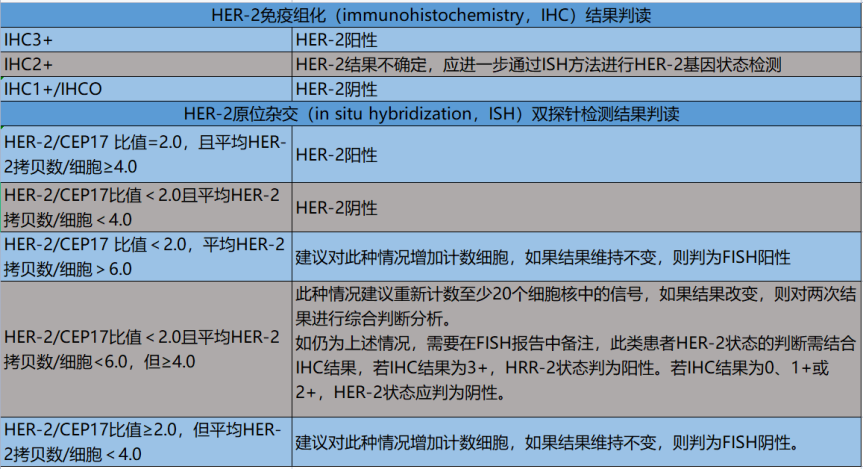
对于HER-2/CEP17比值<2.0,平均HER-2拷贝数/细胞≥6.0的病例,研究显示,若采用第17号染色体上的其他探针替代CEP17,此组病例中相当一部分的检测结果转变为HER-2/第17号染色体替代探针的比值>2.0,平均HER-2拷贝数/细胞≥6.0,此组特殊人群宜有更多循证医学依据的积累。
对于HER-2/CEP17比值≥2.0,但平均HR-2拷贝数/细胞<4.0的病例,在现有的临床试验数据中,缺乏充分依据显示此部分患者能从抗HER-2靶向治疗中获益,对此组特殊人群尚需积累更多循证医学依据。
基于HER-2低表达患者可能从新型抗体偶联药物治疗中获益,且已有临床研究正在进行。因此,临床中在原有HER-2阴性定义的基础上,将HER-2 IHC 1+或IHC 2+且ISH阴性的患者定义为HER-2低表达,而IHC结果为0定义为HER-2阴性。鉴于HER-2蛋白低表达及阳性表达对于患者治疗及预后有重要意义,建议在每次染色过程中都加入阳性和阴性对照。
对所有的乳腺浸润性癌和非浸润性瘤标本进行雌、孕激素受体状态检测。ER检测中有循证医学证据的是ERα抗体,建议使用国家药品监督管理局(NMPA)认证批准的检测试剂,建议按照2020版ASCO/CAP指南对ER和PR检测进行更新,ER、PR免疫组织化学检测的阳性阈值仍为> 1%,阳性应报告染色强度和阳性肿瘤细胞的百分比,但新增ER弱阳性判读。ER具体判读标准如下。

经验证的IHC是预测内分泌治疗获益的推荐标准检测,不建议使用其他分析方法。注意评估ER表达与组织学表现的一致性。建议使用扁桃体组织或宫颈组织作为外对照。此外,应制定并遵循SOP以确认染色强度为弱或仅有10%细胞核着色病例的ER结果,应报告0-10%着色的病例的内对照。
专家普遍认同PR是重要的乳腺癌预后指标,建议将PR 20%阳性作为Luminal A型和Luminal B型的临界值。
应对所有乳腺浸润性癌病例进行Ki-67的检测,并对癌细胞核中阳性染色细胞所占的百分比进行报告,阳性定义为浸润癌细胞核任何程度的棕色染色。2021年“乳腺癌Ki-67国际工作组评估指南”推荐采用标准化的“打字机”视觉评估法进行判读,要有严格的质量评估保证和控制体系,确保分析的有效性。
PD-L1在乳腺癌中的评估
临床研究显示PD-L1表达水平可能与PD-1/PD-L1抑制剂疗效相关,PD-L1表达水平的准确评估将会影响患者的后续治疗。
良性的扁桃体组织是一种理想的对照组织,包含阳性和阴性染色的上皮细胞和免疫细胞,可作为PD-L1伴随诊断的阳性和阴性对照组织。阴性对照显示无细胞膜染色且无非特异性染色背景。报告中应标明所检测抗体克隆号及评分方式。

肿瘤相关间质是指当将肿瘤细胞定位在近似20×的视野的中心,同一视野内出现的PD-L1染色淋巴和巨噬细胞应被包括在分子中(放大20倍)。