心血管疾病(CVD)是全球人类面临的主要健康挑战之一,也是我国城乡居民死亡的首要原因。在CVD中,急性心肌梗死(AMI)的发病率和死亡率呈逐年增长趋势[1]。据2014年中国PEACE协作组的研究报告,我国AMI人数在2001年~2011年的十年里增加了4倍[2]。马尔科夫模型预测,未来20年中国将新增2100万例急性冠脉事件,发生700万例心源性死亡[3]。鉴于如此严峻的发病形势,AMI防治成为临床关注的重点。
随着近年医疗水平的提升、介入治疗及基于循证的最佳药物治疗(包括抗凝、抗血小板、降脂治疗等)的应用,AMI患者的预后得到了极大的改善,但仍有部分患者面临心血管“残余风险”,与肥胖、糖尿病等代谢紊乱相关的炎症状态被认为是重要的“炎症残余风险”。近年来,干预不同炎症靶点的研究成为心血管代谢领域备受关注的热点,一些研究已证实干预炎症可以改善AMI患者的心血管不良事件再发风险,为临床优化AMI的管理提供了全新视角。
本文特邀中国医学科学院阜外医院郭远林教授,为我们解析炎症与AMI发生发展的关系,以及AMI抗炎治疗的研究进展和临床思考。
动脉粥样硬化炎症理论
其实,动脉粥样硬化机制的“炎症学说”可以追溯到1858年,德国病理学家Virchow R发现某些动脉粥样硬化病变具有活动性炎症的性质,但该观点在当时未受充分重视[4]。直到20世纪70年代,美国病理学家Russel Ross提出“损伤-反应”学说,认为动脉粥样硬化斑块的形成是血管壁对各种损伤的反应、其性质与炎症相似,1990年又将其修改发展为“炎症学说”[5]。此后,越来越多基础研究和临床研究,不断地夯实着炎症学说[6]。后续动脉粥样硬化性心血管疾病抗炎治疗领域标志性临床研究—— CANTOS研究[7] 、COLCOT研究[8] 以及 LoDoCo2研究[9]的开展为动脉粥样硬化抗炎治疗进一步走向临床应用提供了高水平循证医学证据(图1)。
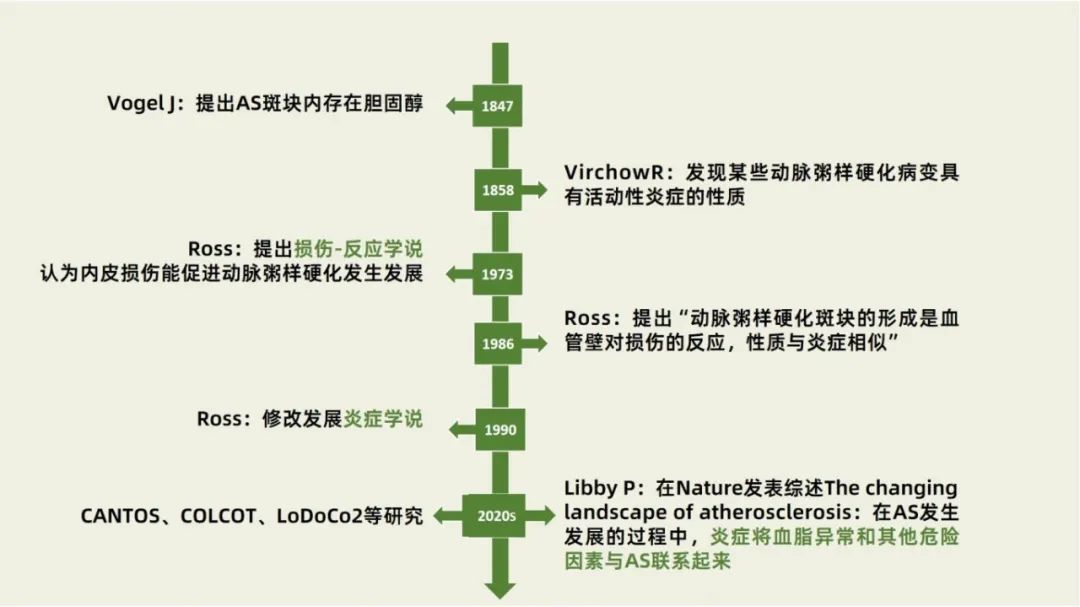
图1 动脉粥样硬化炎症学说发展历史
AMI作为动脉粥样硬化性心血管疾病中的急重症,一直是临床关注的重点。最近的研究证据也强调了炎症及免疫细胞和分子途径与缺血性心肌损伤的重要相关性。炎症介质在斑块破裂或侵蚀导致的AMI发病过程中发挥着关键作用[10]。炎症标志物水平升高是AMI事件发生的前兆,AMI事件后也伴随着过度炎症反应的发生[11]。从治疗的角度看,目前针对AMI血栓形成及动脉粥样硬化进展的指南推荐最佳药物治疗方案包括:抗血小板/抗凝治疗、降脂治疗、靶向拮抗肾素-血管紧张素-醛固酮系统的治疗以及β受体阻滞剂治疗[12]。但是值得注意的是这些治疗方案尚未包含任何单独抗炎治疗的药物。此外,尽管低密度脂蛋白胆固醇(LDL-C)作为AMI的传统风险因素的重要性已经确立,但就目前的循证依据来看似乎对于AMI改善预后的关注点不能仅止步于降低“胆固醇风险”。在一半早期亚临床动脉粥样硬化的无症状患者中,并未表现出传统的心血管危险因素,如吸烟、高血压及血脂异常[13]。事实上,许多AMI患者并未表现出LDL-C水平的升高,但该部分患者的炎症相关介质的水平却有升高。而且,在已经接受强效降脂治疗的患者中,与传统风险因素LDL-C相比,通过高敏C-反应蛋白(hs-CRP)评估的炎症成为未来心血管事件的更强预测因素[14]。
这不禁让我们思考,目前炎症引起AMI发生发展的机制如何?临床研究进展如何?未来真实工作中如何为AMI患者进行抗炎治疗?
炎症引起AMI发生发展的机制:
“好的”“坏的”和“丑的”
为了更好地厘清炎症在AMI发生发展中的作用,近期有学者将AMI后的炎症反应形象地分为“好的”“坏的”和“丑的”三类(图2)[12]。
“好的”炎症指的是在AMI后,炎症反应对身体产生的积极作用。在这一阶段,某些细胞和细胞因子,如IL-10和IL-2,通过协调调节T细胞(Tregs)和巨噬细胞之间的相互作用,最终促进组织愈合;2型辅助T细胞(Th2)和Tregs激活M2巨噬细胞产生一系列介质(例如胰岛素样生长因子-1、纤维连接蛋白、转化生长因子-β、IL-10和血管内皮生长因子),从而促进损伤心肌细胞的修复。
“坏的”炎症指的是AMI后期持续存在的低度炎症状态,也被称为低度残余炎症风险(RIR)。这种炎症可能导致心脏组织的慢性损伤和功能下降,对患者的长期预后产生负面影响。M1巨噬细胞、泡沫细胞和多形核白细胞(PMNs)是这一阶段炎症的主要参与者;这些炎性细胞的激活会伴随巨噬细胞的活化,NLRP3炎症小体[核结合富含NOD-, LRR- 和pyrin结构域(NLRP)3炎症小体]组装,导致IL-1β活化,产生大量IL-6,刺激肝脏细胞产生CRP,随后在血管内扩大炎症信号。
“丑的”炎症指的是AMI发生后早期发生的过度炎症反应。这种炎症反应在斑块破裂和血栓形成后立即开始,并通过中性粒细胞外泌网(NETs)的形成、氧化爆发以及IL-1和IL-6等关键细胞因子剧烈的激增而加剧。最终“坏的“和“丑的”炎症共同促进不良心血管结局事件的发生。
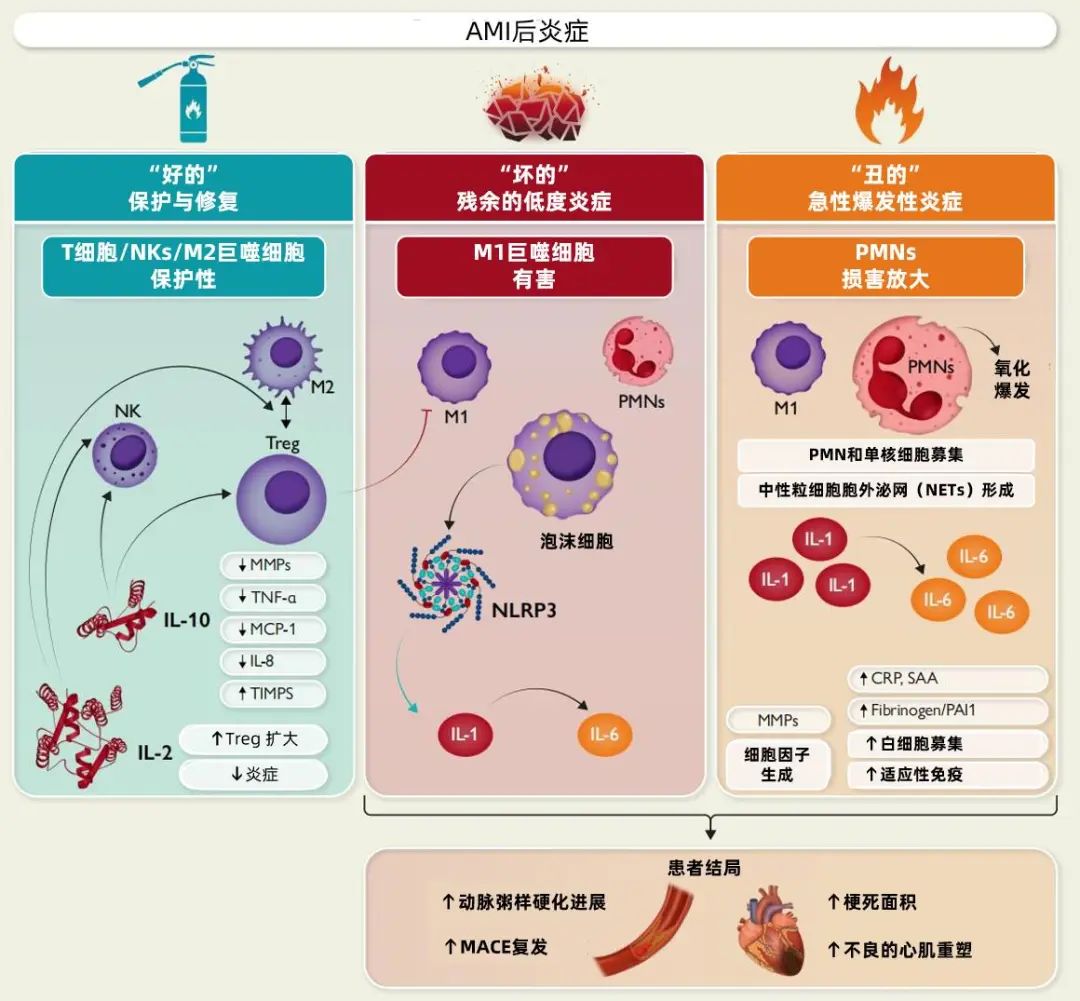
图2 AMI后炎症的三种类别
注:AMI 急性心肌梗死,NK 自然杀伤细胞,PMN 多形核白细胞,Treg 调节性T细胞,MMP 基质金属蛋白酶,TNF-α 肿瘤坏死因子- α,IL 白介素,TIMPS 金属蛋白酶组织抑制因子,CRP C-反应蛋白,SAA 血清淀粉样蛋白A,Fibrinogen 纤维蛋白原,PAI1 纤溶酶原激活物抑制物-1,MACE 主要不良心血管事件
心肌梗死抗炎治疗的临床研究
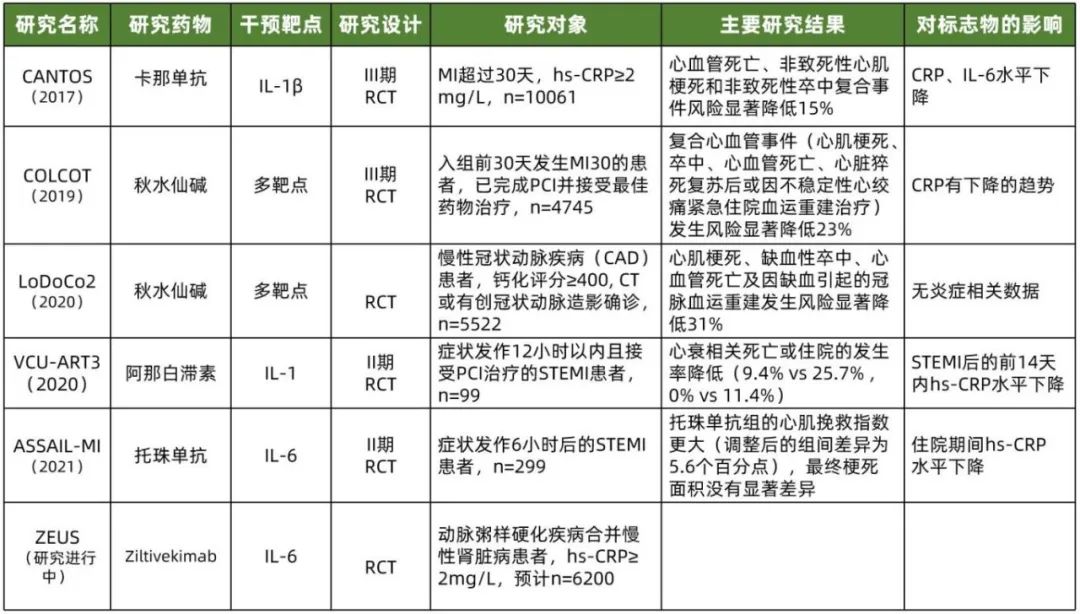
基于以上分类,保留“好的”炎症,治疗“坏的”和“丑的”炎症,无疑是AMI抗炎治疗的合理策略。而纵览当前已经结束的或正在进行的大型临床研究也正是主要集中在如何干预“丑的”和“坏的”炎症,主要的干预靶点集中在IL-1β、NLRP3炎症小体及IL-6(表1)。
表1 心肌梗死抗炎治疗部分研究概览
临床研究的进展也直接推动了心血管指南共识更新。基于LoDoCo2、COLCOT研究结果,《2021 ESC心血管疾病临床实践预防指南》[15]在“个体化水平危险因素干预”部分提出了“抗炎治疗方案”,指出低剂量秋水仙碱(0.5 mg/d)可考虑用于 CVD 的二级预防,尤其是在其他危险因素未得到充分控制或在最佳治疗下发生复发性 CVD 事件时(Ⅱb,A)。《2023 ESC急性冠脉综合征管理指南》[16]也推荐低剂量秋水仙碱(0.5mg/d)用于CVD的二级预防(Ⅱb,A)。
hs-CRP作为目前临床最常用的评估炎症的生物标记物,也被国内外指南共识推荐用于心血管风险评估:《2018 AHA/ACC成人胆固醇管理指南》[17]、《2021加拿大心血管疾病预防成人血脂管理指南》[18]、《中国心血管病一级预防指南》[19]及《中国血脂管理指南(2023年)》[20]都推荐hs-CRP≥2 mg/L作为心血管风险评估的风险增强因素。
临床思考:合适的标记物,合适的靶点,合适的治疗窗口及感染风险
回顾过往,AMI抗炎治疗领域的探索步履不停,不断有新的研究和新的理论给人以启迪。然而展望未来,AMI的抗炎治疗仍有很长的路要走。选择什么样的患者,基于哪个靶点,在什么时间节点给予怎样的个体化用药方案,这些环节都有诸多疑问有待进一步探明。
hs-CRP是目前临床上应用最广泛的炎症标志物。临床研究也证实高水平的hs-CRP与心血管事件风险相关,国内外指南也推荐其作为心血管风险评估的风险增强因素[17-20]。但这一指标也同时存在变异性较大及心血管特异性不强等缺陷。而IL-6 目前多用于临床研究或临床特殊病例中作为炎症指标进行检测,尚未进入临床常规检测阶段。
心肌梗死面积也可作为高炎症负荷的标志物,但该指标临床应用也面临着如何平衡评估的及时性与准确性的挑战。
对于合适抗炎靶点的选择,当前主要的挑战之一即是避免干扰AMI发生后与心肌保护和修复相关的(即“好的”) 炎症反应过程,对此,目前认为选择炎症信号通路中的下游介质作为靶点或可最大限度减少这方面的影响,基于现有的抗炎CVOT研究证据提示,NLRP3炎症小体,IL-1相关通路中的因子如IL-1α和IL-1β,及其下游介质IL-6均是较有前景的靶点。首次证实了抗炎药物在冠心病中作用的CANTOS研究中就选取了IL-1β作为抗炎靶点,然而IL-1β单抗因致死性感染的增加最终未能应用于心血管临床。
为了有效消除AMI后初期爆发性炎症反应,临床需要靶向早期激增的炎症介质,即在缺血损伤后的早期阶段(如12小时内)进行抗炎治疗,由此发挥心肌保护作用。VCU-ART3研究[21]、ASSAIL-MI研究[22]的结果支持上述推论,但ASSAIL-MI研究也提示,过早(≤3小时)的干预可能会影响治疗效果。
虽然,在CANTOS研究中和安慰剂对照组相比,卡那单抗显著降低了炎症合并心梗后患者的主要不良心血管事件风险。但是,同时也显著增加了试验组患者的感染风险[12]。如何在抗炎治疗中,平衡抗炎和感染也是值得我们思考的问题。
百余年来,炎症在动脉粥样硬化发生发展中的重要作用一直有被提及,但受困于炎症是一把双刃剑,这一领域多年来进展有限。随着CANTOS、COLCOT及LODOCO2等研究的成功,动脉粥样硬化炎症学说的证据链得以逐步完善。作为冠心病中危重类型的AMI,有着更多的未被满足的临床需求,这些设计严谨的对AMI患者进行早期、有针对性的抗炎治疗的临床试验,为后续AMI患者抗炎治疗铺平了道路。但总体而言,AMI抗炎治疗无论在基础研究还是临床研究层面,都仍有诸多疑问有待进一步探明,值得广大临床医生对此给予更多关注。
-END-
声明:本文转载于<心希望快迅>,来源:中国医学论坛报,仅用于学习交流,版权归原作者所有。如有侵权违规,请立即联系我们。