成功开通慢性闭塞病变(chronic total occlusion, CTO)不仅有助于缓解心绞痛,对于部分患者还可以提高生存率,改善预后。但是,CTO是冠脉经皮介入治疗(percutaneous coronary intervention, PCI)最具挑战性的病例之一,随着手术器械的明显改进,在前向技术开通CTO的成功率达到60%的基础上,日本术者首创的逆向技术的推广应用,把开通CTO的成功率提升到新的台阶。下面就如何正确学习掌握CTO介入技术进行简单总结,对于CTO PCI而言,我们再追求成功率的同时,也要高度重视手术安全性,所以在下面的内容中将把如何提高成功率与保障安全性一并分析。
1.1 临床情况评估
作为PCI尚未完全攻克的堡垒,CTO的成功率偏低而并发症风险较高,需要在PCI前进行详尽充分的术前准备。术前准备应包括对患者总体情况的评估,包括临床症状、合并症、心肾功能状态等等。临床情况的准确评估有助于准确判断患者实施PCI的获益、PCI的耐受程度及PCI相关并发症,继而可以进行有针对性的术前准备,如心功能不全患者提前抗心衰处理或在必要时预先实施主动脉内球囊反搏(Intra-aorta Balloon Pump, IABP),肾功能不全患者则进行水化处理,这可以提高PCI的成功率并降低PCI相关并发症。
1.2 冠脉造影评估
除了临床情况的评估,仔细复习阅读冠脉造影是CTO PCI术前准备不可或缺的一环。PCI术前应该对前向和逆向路径中的主支血管进行仔细判读,主要评估主支血管是否存在狭窄性病变。
尤其应该重视路径中主支血管开口病变,由于CTO PCI常需选择强支撑指引导管,且在回撤器械时容易导致指引导管深插,血管开口存在病变将显著增加开口夹层风险,需要预先进行处理。
对于路径主支血管非开口部位的病变,如果狭窄明显同样应该考虑进行预先处理,尤其对于采用逆向技术的供血血管更是如此。以参考血管直径3.0mm的病变为例,如果狭窄程度达到70%,则Corsair微导管(远端体部直径0.87mm)通过后将阻断血流,造成供体血管和受体血管供血范围同时发生缺血,容易诱发血流动力学不稳定。
对于前向技术,J-score仍然是预测手术难度的有效工具,但是,J-score没有包含开口病变和近端纤维帽分叉这两个并不少见的导致前向技术中难度增加的因素,在临床实践中不应对这两类病变掉以轻心。
对于逆向技术,侧支通道(collateral channel, CC)无疑是逆向路径中最重要的一环,发现并准确评估CC对提高CTO PCI的成功率至关重要。
清晰的多投照位造影是发现CC的基础,适当降低图像放大比例及造影过程避免增强器或手术床移动有助于发现细小的CC,同时还需要足够的曝光时间以使CC完全充盈,而双侧造影则有助于发现单侧造影时由于充盈不良而难以显影的CC。CC可分为两种,室间隔CC和心外膜CC。心外膜CC主要包括右室支-前降支、前降支-后降支、对角支-前降支及回旋支和右冠脉之间的左室后支。
在临床实践中,当术者决定采取逆向技术后,在术前阅片时前向路径往往容易被忽略。值得注意的是,尽管选择了逆向技术,其最终目的也是为了建立前向的通路以输送支架到病变部位实施PCI,因此,即使通过体外化的逆向导丝进行器械的输送,前向球囊及支架的通过性也是需要考虑的。如果忽视了前向路径的不利因素如严重迂曲和严重钙化,即使建立了逆向轨道,也可能因为上述因素导致前向器械通过困难而前功尽弃。
血管入路选择是CTO PCI首先要考虑的问题。
选择桡动脉入路还是股动脉入路应该基于对病变特点的判断,如果病变复杂需要强支撑指引导管或者复杂技术需要大管腔指引导管,那么选择股动脉入路可以避免不必要的麻烦。
除此以外,血管入路的选择还需要结合个人经验和喜好,对于熟悉股动脉入路的术者,不应强求使用桡动脉入路进行CTO PCI,而对于熟悉桡动脉入路的术者,则可选择双侧桡动脉作为血管入路,但前提是桡动脉能够满足完成手术所需的指引导管的尺寸要求。
选择合适的血管入路后,接着需要选择合适的指引导管。
指引导管的选择同样应该基于对病变特点的判断和个人经验。由于CTO都属于高阻力病变,大部分病例需要选择强支撑指引导管(如7F甚至8F)指引导管以保证器械的通过性,而使用血管内超声及双腔微导管对指引导管内腔的要求也是选择指引导管应该考虑的因素。
对于指引导管的选择,CC的长度是容易被忽略的一点,但这对于心外膜CC相当重要,尤其对于身材较高的患者,在选择桡动脉入路时,即使选择150cm的微导管可能也无法完全通过明显迂曲延长的心外膜CC,这种情况下需要考虑使用90cm的短指引导管实施逆向技术PCI。
如何通过闭塞病变是CTO PCI的主要挑战,这也是CTO PCI最复杂精彩的部分。
正向技术与逆向技术CTO通过导丝的选择原则与前向技术相似,短直的闭塞病变可使用Conquest系列穿刺导丝而较长或迂曲的病变则可考虑Miracle和Pilot系列导丝钻探通过闭塞段,而有微通道的病变可以使用Fielder XT系列导丝寻径通过,术者可以根据病变特点和个人经验选择使用。
值得一提的是,在日本,Pilot系列导丝已经较少用于CTO PCI,Miracle系列的比重也在下降,新一代的CTO导丝Gaia渐受推崇。Gaia导丝是预塑形导丝,特有圆形核心和圆形头端设计,塑形后其头端旋转面积仅为28.26×10-6inch2,显著小于所有其他CTO导丝,意味着其可以实现精准的操控。Gaia特有的设计还使其具有良好的扭矩传输及推送力传输,虽然其头端硬度分别只有1.5g(Gaia 1)和3.5g(Gaia 2),但其穿刺强度却分别达到53.1kg/ inch2和123.8 kg/ inch2,分别超过Miracle 6(39.0kg/ inch2)和Miracle 12(78.0kg/ inch2),Gaia 2穿刺强度也接近于Conquest Pro(141.5kg/ inch2)的水平。由于具备精准操控和良好穿刺力,Gaia导丝目前已逐渐成为日本术者首选的CTO通过导丝。
另一方面,相比于近端纤维帽,远端纤维帽硬度较低,小部分病例可使用Sion等CC通过导丝进行逆向穿越CTO的简单试探,但如果此类导丝难以胜任逆向穿越CTO的任务,则需尽快通过微导管交换CTO专用通过导丝。
不管选择种导丝,不管正向还是逆向技术,通过CTO体部前应该尽一切可能了解掌握CTO段的走行,以此指导导丝行进的方向,减少冠脉穿孔的机会。
对于走行不清晰的闭塞段,可以考虑Knuckle导丝技术,该技术在提高通过效率的同时,由于是通过钝性分离的机制前行,导致血管穿孔的机会较低,但是,Knuckle导丝技术导致内膜下血肿范围较大,因此可增加后续操作的难度,在使用前需要对其优劣进行综合评估。
4.1 CC通路的建立
CC通路的建立是逆向技术的关键步骤,而选择合适的CC是成功建立CC通路的第一步。清晰的多投照位造影是寻找合适CC的重要手段,如果非选择性造影难以显示出满意的室间隔CC,可以考虑通过微导管在间隔支近端行选择性造影。但是选择性造影可导致CC穿孔及心肌血肿而令该CC失去使用价值,不应该作为寻找CC的常规手段而频繁使用。
相比于心外膜CC,室间隔CC安全性更高,因此应该作为逆向技术的首选通路。对于室间隔CC而言,导丝等器械能否顺利通过主要取决于其迂曲程度而非尺寸大小,因此选择走行较直的室间隔CC有助于提高逆向技术的成功率。与室间隔CC相反,心外膜CC尺寸大小可明显影响器械的通过性而迂曲程度则对器械通过性影响较小,因此,应该尽量选择直径较大的心外膜CC以提高器械通过成功率。
导丝和微导管的选择对于能否成功建立CC通路同样举足轻重。Sion和Fielder FC是国内使用最为广泛的CC通过导丝,两者都属于软导丝,安全性高,不易造成CC夹层或穿孔。
Sion导丝为复合核心和双层弹簧圈结构,具有良好的触觉反馈和操控性,可作为通过CC的首选导丝,而Fielder FC属于超滑导丝,可用于通过严重迂曲的心外膜CC。
Asahi公司还在Sion的基础上研发出Sion blue导丝,其结构和Sion相同但是头端更软(0.5g),可安全用于“冲浪技术”寻找室间隔CC。相比于导丝的多样性,目前可供选择的微导管主要为Finecross微导管和Corsair微导管。
Finecross微导管杆部为不锈钢编制辫状结构并呈锥形,头端外径为0.60mm而近端外径为0.87mm,可提供较好的支撑以助导丝通过CC,具有130cm或150cm两种长度可供选择。
Corsair微导管同样有两种长度,一种长度为135cm多用于前向介入治疗,而另外一种长度为150cm主要用于逆向介入治疗。Corsair微导管结合了Tornus导管及微导管的特性,其头端5mm为逐渐变细的柔软部分并涂有钨粉,柔顺性较好。由于其头端为锥形设计,比Finecross更容易以钻探方式通过CC,因此被称为扩张微导管,目前已成为室间隔CC的首选微导管。虽然在室间隔CC通过性方面不如Corsair,但是Finecross微导管柔软度优于Corsair,对于Corsair难以通过的严重迂曲的心外膜CC,Finecross较易跟随导丝通过CC进入受体血管。
4.2 技术的选择
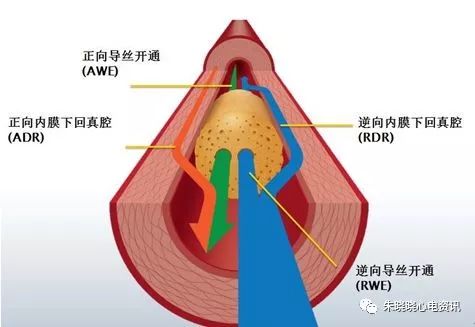
当逆向导丝进入闭塞段后,如果认为导丝行走于真腔,可尝试操控逆向导丝直接通过闭塞段。但是,如果认为逆向导丝位于内膜下,则不应进行过多的尝试,以免对血管尤其近端纤维帽以近的血管造成明显损伤。
同样,由于耗时且成功率不高,当逆向导丝进入闭塞段后,目前已不主张操控前向导丝进行导丝对吻,而是主张尽早应用Reverse CART(Reverse controlled antegrade and retrograde sub-intimal tracking)技术。为了提高成功率同时避免冠脉穿孔等并发症,使用Reverse CART技术需要注意以下几点:
一是前向逆向导丝尽量重合;
二是导丝(尤其前向导丝)尽量放置于闭塞血管的中线位置;
三是参考血管直径或IVUS直接测定的外弹力膜直径选择合适大小的前向扩张球囊避免过分扩张;
四是在前向球囊完成扩张后支架植入前尽量避免前向造影,以免扩张后产生的夹层向远端延伸。
4.3 处理闭塞病变
当逆向导丝及微导管通过闭塞段进入近端真腔以后,术者可以根据病变特点和自身经验决定使用逆向轨道或者前向轨道完成PCI。
使用逆向轨道的优点是可以提供强大的支撑,但需要把CTO通过导丝交换为300cm以上长导丝如Pilot 200及RG3,如果逆向长导丝无法进入前向指引导管,可把其送入主动脉后利用抓捕器完成体外化。在利用抓捕器进行逆向导丝体外化时切忌粗暴操作,以避免对室间隔及冠脉造成切割性损伤,同时还应该紧密关注逆向指引导管位置,避免深插造成开口夹层。同样道理,在通过体外化导丝前向输送器械时也应该时刻注意逆向指引导管位置。通过逆向轨道完成支架植入后,后撤逆向轨道的顺序应该是先导丝后微导管,其原因同样是出于保护室间隔的考虑,并且,在逆向轨道完全撤出前,应复查造影排除血管尤其CC穿孔等并发症。
如果不进行逆向导丝体外化,则需建立前向轨道完成PCI,此时可以考虑使用Rendezvous技术。把逆向微导管和前向导丝置于前向指引导管转折部位有助于提高前向导丝进入逆向微导管的机会。需要注意的是,即使在前向导丝通过闭塞段进入远端真腔以后,球囊和支架定位时仍需避免前向造影,而是通过逆向造影辅助定位,一来可以避免夹层延伸,二来闭塞病变扩张后往往弹性回缩,前向造影显影效果欠佳。
5、 造影剂肾病的预防
由于操作繁杂,CTO PCI往往需要使用较大量的造影剂,造影剂肾病风险较高。以下几点有助于减少PCI过程中造影剂的使用。
一是术前仔细阅片。充分了解PCI各阶段的最佳投照体位,避免反复造影。在导丝行走于闭塞段时,造影不仅无助于判断导丝位置还可扩大导丝所引起的内膜下血肿,应该尽量避免;
二是在寻找CC和前向器械定位时适当使用选择性造影。但如前所述,选择性造影可增加CC穿孔风险,应谨慎使用;
三是充分利用标记物进行器械定位。逆向导丝和微导管可看作为前向球囊和支架定位的标记,有助于减少造影剂的使用。
CTO PCI技术操作复杂,但是可以通过认真的学习与总结逐步掌握,在充分学习的基础上进行精心的术前准备,可以在获得较高成功率的同时避免并发症,令患者从中获益。
本文作者:陈纪言 何鹏程 广东省人民医院
本文来源:朱晓晓心电资讯