
大部分多发性骨髓瘤患者在病程中会出现骨髓瘤骨病,严重影响患者的生活质量和生存率。规范的化疗、靶向治疗和双膦酸盐是治疗多发性骨髓瘤骨病的基础和最重要的部分。外科手术在多发性骨髓瘤骨病急性并发症(病理性骨折、脊柱不稳和脊髓压迫症等)的治疗中发挥着重要作用。中国医师协会骨科医师分会骨肿瘤专业委员会依据循证医学方法制定了《多发性骨髓瘤骨病外科治疗循证医学指南》,分别就外科治疗时机、手术指征、不同部位的手术方式及综合治疗等临床问题进行总结,依据文献证据等级给出相应的推荐等级。专业委员会希望本指南能够为骨肿瘤医师的临床诊疗提供最佳的、有效的意见参考,从而使患者达到最佳的治疗效果。而本指南仅为学术性指导意见,具体实施时必须依据患者的个体医疗情况而定。
多发性骨髓瘤(multiple myeloma, MM)好发于中老年人,西方国家多发性骨髓瘤发病的中位年龄为69岁,我国为59岁;发病的男女比例为1.54∶1。流行病学统计显示,全球每年新发病例数约86000人。
多发性骨髓瘤骨病(multiple myeloma bone disease, MMBD)是指由于骨髓瘤溶骨破坏导致的病理性骨折、脊髓与神经根压迫症、骨质疏松、高钙血症以及骨痛等一系列临床并发症的总称,在骨髓瘤患者中的发生率高达80%以上。多发性骨髓瘤骨病的发生机制主要是由于骨髓瘤细胞激活破骨细胞的同时抑制了成骨细胞活性,最终导致骨代谢失衡。
MMBD常累及扁骨,包括颅骨、脊柱、骨盆、肋骨及胸骨,四肢长骨病变以股骨和肱骨最为常见。疼痛是MMBD最常见的症状,多发生于腰背部及胸肋部,超过50%的患者在其自然病程中会发生病理性骨折,8%~10%的脊柱病变患者会出现神经功能损害,严重时会出现脊髓压迫导致截瘫及二便障碍。骨髓瘤骨骼浸润明显时可导致骨相关事件(skeletal related events, SRE),即病理性骨折、脊髓压迫、高钙血症、为缓解骨痛进行的放射治疗,为预防或治疗脊髓压迫或病理性骨折进行的外科手术等。
随着近年来骨髓瘤化疗、干细胞移植和靶向治疗领域的一系列突破,大多数MMBD都可以通过内科系统性治疗得到有效控制,但面对一些特殊情况时,外科治疗仍是一种不可或缺的手段。
本指南旨在通过循证医学证据回顾,确定多发性骨髓瘤骨病外科治疗的诊疗规范,最大限度地恢复MMBD患者的生活质量,避免严重并发症的发生以及过度医疗给患者造成的不必要伤害。
证据推荐等级方法采用GRADE (Grading of Recommendations Assessment, Development and Evaluation)方法,详见表1。

3.1 诊断标准
参考WHO、美国国立综合癌症网络(NCCN)、国际骨髓瘤工作组(IMWG)和英国血液学标准化委员会/英国骨髓瘤协会指南工作组的指南,诊断有症状骨髓瘤(活动性骨髓瘤)和无症状骨髓瘤(冒烟型骨髓瘤)的标准及相关检查(表2~4)。(1A级)


3.2 已确诊MM患者的骨破坏评估
对于已确诊的MM患者来说,X线检查是常规诊疗手段,CT和MRI检查可以发现更多的无症状病灶。欧洲骨髓瘤学会(EMN)强烈推荐应用全身低剂量CT扫描(whole-body low-dose computed tomography, WBLD-CT)评估MMBD的骨骼受累范围(1A级),这一技术可以在2min内完成全身骨骼扫描,更有助于发现潜在骨折风险和影响脊柱稳定性的病变。如果无法行WBLD-CT,也可以使用骨盆、脊柱CT扫描和常规X线检查。脊柱和骨盆MRI对预后判断有重要意义(1B级),与常规X线检查相比,MRI可以发现一些更小的无症状溶骨破坏,无症状MM患者如果在MRI检查中发现2个以上溶骨破坏灶,极有可能(>70%)在2年内进展为有症状MM。PET/CT有助于更好的定义完全或深度缓解(CR或sCR)和疾病进展(2B级)。骨扫描(ECT)反映骨合成,而MM以溶骨破坏为主,成骨代谢减弱,因此,ECT不作为MMBD的常规检测。
3.3 不明原因骨破坏
对没有MM病史而因骨痛、骨质破坏、病理性骨折、软组织肿块或神经压迫症状首诊于骨科的患者,在除外其他疾病的同时应考虑MM的可能,进行相关的骨髓检查及血、尿免疫球蛋白检测。单发骨破坏及四肢软组织肿块也应考虑到孤立性浆细胞瘤或髓外浆细胞瘤的可能。检查项目见表4。(1B级)

3.4 活检手术
穿刺活检和开放活检均可应用,根据部位及病情决定。原则上选择病变明显、创伤小、易操作、远离重要血管神经、对后续诊治影响小的部位。活检前应仔细阅读各种影像学资料,复习检验结果,骨科和血液科医师共同决定活检部位。标本应分别做血涂片、骨髓涂片、组织病理、流式细胞和染色体检查。(1C级)
除病理性骨折和急性截瘫患者外,其他患者在接受外科治疗前建议接受一个疗程以上血液科医师主导的全身化疗,之后再次评估手术的必要性(1C级)。规范的化疗、靶向治疗和自体干细胞移植是治疗MMBD的基础和最重要的组成部分(1A级)。蛋白酶体抑制剂在抑制溶骨破坏方面的作用显著(1A级)。
所有肌酐清除率≥30ml/min的MM患者,在接受全身抗骨髓瘤治疗的同时,还应当给予患者静脉注射唑来膦酸(4mg,至少输注15min,每3~4周1次)或帕米膦酸二钠(90mg,输注2~4h,每3~4周1次)(1A级)。唑来膦酸应持续给药,一般建议用药2年,但应注意预防下颌骨坏死等严重并发症(2C级)。
放射疗法可用于孤立性浆细胞瘤、早期脊髓压迫症、药物无法缓解的严重骨痛,并用于预防病理性骨折。10~15次剂量为3000cGy的放射治疗即可获得极好的效果。在缓解顽固性骨痛方面,单次放疗(通常是8~10Gy)的作用与分次放疗作用相仿(1B级)。放射疗法与二膦酸盐类药物有协同作用,但可引起一些药物的延迟毒性,比如蒽环类药物和蛋白酶体抑制剂。
6.1 概述
面对病理性骨折、截瘫等特殊情况时,外科治疗是一种不可或缺的手段。外科治疗最基本的原则是尽快恢复患者生活质量,同时尽可能保证在患者生存期内局部无需二次手术。骨髓瘤外科治疗的目的不是根治疾病,而应以缓解症状、提高生活质量为重点,通过手术早期干预治疗潜在的或已经发生的病理性骨折、解除脊髓与神经根压迫或清除溶骨性病灶、缓解疼痛,重建骨连续性及脊柱的稳定性,为患者后续的治疗创造条件。目前尚缺乏大规模的临床病例对照研究证实手术能否延长患者的总生存期。
6.2 手术指征
①多发性骨髓瘤导致脊柱压缩骨折和(或)脊柱不稳;②脊柱病变压迫脊髓与神经根致神经功能损害进行性加重;③药物和(或)放疗无法缓解的严重骨痛;④四肢长骨病理性骨折或存在潜在病理性骨折风险;⑤穿刺或切开活检。(1C级)
6.3 禁忌证
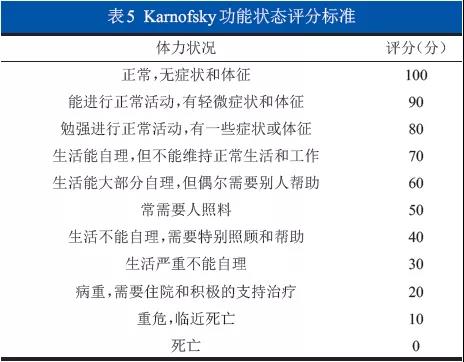
全身状况差,不能耐受手术者;心、肺、肾、肝功能衰竭不能控制者;凝血功能严重障碍不能纠正者;合并严重感染不能控制者。建议应用Karnofsky评分(表5)评价生活质量。患者在接受外科治疗前,应由血液科医师进行严格的评估,参照分期和危险分层对预后进行判断(预期生存时间>3个月)。(1C级)
6.4 手术时机
当出现下面两种情况时建议尽快手术:①短时间内迅速进展的截瘫;②长骨病理性骨折。其他情况均建议首先接受一个疗程以上血液科医师主导的全身系统治疗后再次评估手术必要性。(1C级)
6.5 麻醉及手术方式的选择
首选全身麻醉,因为椎管内麻醉或其他麻醉方法均有一定创伤性,有导致出血、感染的危险,另外此类患者身体虚弱,全身麻醉相对更便于控制血压、血氧饱和度、呼吸等生命指标。(1C级)
6.6 长骨病变
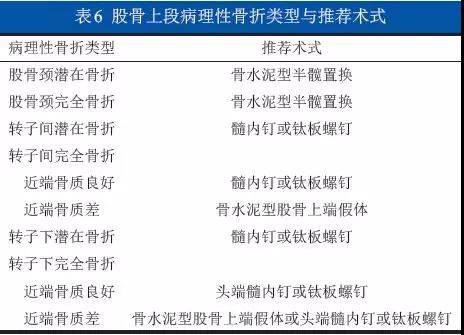
6.6.1 已发生病理性骨折:手术治疗四肢长骨病理性骨折疗效确切,能有效缓解疼痛、恢复骨连续性、有利于恢复肢体功能,提高生活质量。根据病变破坏部位和范围,手术包括病灶切除(广泛或边缘)和刮除(囊内)两种。刮除后骨缺损处可以填充骨水泥,再根据不同的部位选择内固定方式,可应用螺钉、钛板或髓内钉。病变切除后大段骨缺损可行肿瘤型人工假体置换术;不建议采用异体骨或灭活再植等生物重建方式。手术切除和重建策略见表6。(1B级)
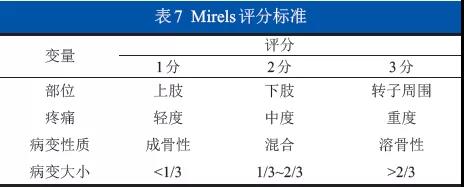
6.6.2 存在潜在病理性骨折风险:建议确诊骨髓瘤患者接受全身低剂量CT检查,对于有潜在病理性骨折风险的部位实施预防性内固定或密切随访。推荐应用Mirels评分系统(表7)作为预测病理性骨折风险的手段。选择刮除术的患者可应用局部化学物理灭活等方法扩大安全外科边界,刮除后骨缺损处可以填充骨水泥,如未达到R0边界术后需辅以放疗。(1C级)
6.7 脊柱病变
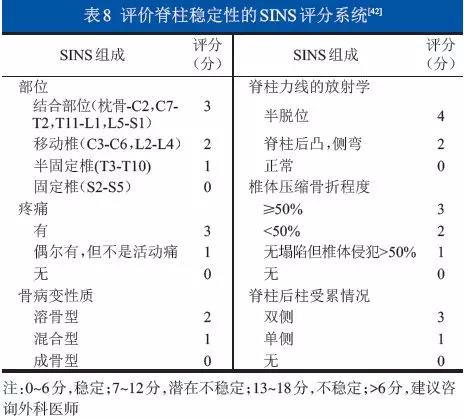
大多数脊柱受累的MM患者在接受系统内科治疗后胸背部疼痛症状会有不同程度的缓解。但椎体高度损失严重和(或)脊柱不稳造成的疼痛很难通过内科治疗和放疗控制,而当脊髓和神经根受到肿瘤或破碎骨折块压迫时可能出现更严重的疼痛甚至发展为截瘫。这些情况出现时应该建议患者咨询骨科医师,并接受相应的外科治疗。推荐应用SINS评分判断脊柱稳定性(表8)。(2C级)
6.7.1 椎体成形术(PVP和PKP):PVP和PKP主要用于治疗椎体压缩骨折导致的剧烈疼痛,约80%对镇痛药无效的严重疼痛患者可得到不同程度的缓解。治疗前首先应明确诱发疼痛的责任椎体,当椎体高度压缩大于1/3,或SINS评分介于7~12分之间时,可采用PVP和PKP治疗(2C级)。椎体后壁不完整的病例应慎重选择PVP或PKP。目前所有循证医学证据中,一项Ⅲ期临床研究显示,PKP可有效缓解骨髓瘤导致椎体压缩骨折诱发的疼痛,与PVP相比可降低骨水泥渗漏的发生率(1A级)。
6.7.2 脊柱压缩骨折和(或)脊柱不稳定:MM患者脊柱病变SINS评分≥13分时,简单的微创手术无法恢复脊柱稳定性,患者需要接受开放手术重建脊柱稳定性,脊柱不稳合并局部肿瘤进展造成脊髓和神经根卡压症状时应同时进行减压手术。(2C级)
6.7.3 脊髓与神经根压迫症:快速进展的脊髓功能受损、椎管内游离骨折块造成的脊髓压迫应尽早手术治疗。神经功能评价目前常用Frankel分级(表9)。根据病灶的部位、大小和手术目的等选择不同的手术方式。手术操作包括在保证安全的前提下尽可能切除肿瘤、椎管减压、脊柱重建和内固定(后路椎弓根钉内固定系统、人工椎体、钛网、骨水泥)。未达到R0边界时需辅以放疗。(1C级)

除了单纯脊柱开放手术外,也可将开放外科手术与微创手术联合应用,可以最大限度地发挥二者的优势,减少术中出血量及合并症的发生,主要适用于脊柱多发病灶的MM患者。手术必须要考虑患者的全身情况和预后情况,以重建脊柱的稳定性和解除压迫症状为主要目的。脊柱孤立性浆细胞瘤如果伴有脊髓神经根压迫或存在严重脊柱不稳时可选择全椎体切除术,该类手术风险大,手术医师需要有丰富的脊柱肿瘤外科手术经验。(2C级)
6.7.4 骶骨病变:骶骨骨髓瘤可以造成顽固性疼痛、二便障碍,如果内科治疗和放射治疗无效,可采取手术治疗。手术应以解除骶神经根压迫为主要目的。骶髂关节连续性受损者应恢复其连续性以缓解疼痛。(2C级)
6.8 骨盆手术
6%的多发性骨髓瘤患者会出现骨盆溶骨性破坏。无症状患者先接受内科系统性治疗,当疼痛症状明显而骨盆环结构完整时,可行放疗。如病变累及髋臼和骶髂关节影响生活质量或伴发病理性骨折时,可行病变切除或刮除、骨水泥填充,同时行骶髂关节固定和髋臼重建。参见表10中Harrington髋臼转移癌分型。未达到R0边界时需辅以放疗。(1C级)

6.9 孤立性浆细胞瘤
孤立性浆细胞瘤的诊断标准:①浆细胞克隆性增殖造成的单一区域的骨骼破坏;②局部病变以外的骨髓细胞形态学检查和骨髓活检正常;③局部病变以外的骨髓检查包括长骨X线检查正常;④没有因浆细胞病造成的贫血及高钙血症或肾衰竭;⑤血清或尿液单克隆免疫球蛋白缺乏或水平低下;⑥脊椎骨MRI扫描没有发现其他的损害。很多孤立性浆细胞瘤会进展为MM,这部分患者可能不太适宜接受广泛或根治性切除手术,而应选择放射治疗。因此由经验丰富的血液科医师根据流式细胞和染色体分析结果对高危病例进行的筛查和评估非常重要。低危的孤立性浆细胞瘤若能早期发现、早期治疗,预后较好,如果病变局限易于切除,可行扩大或边缘切除术。未达到R0边界需辅以放疗。(2C级)
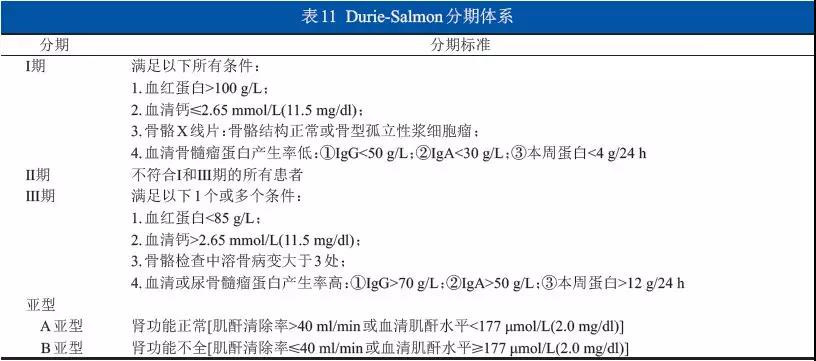
MMBD患者的预后主要取决于初诊时的风险分层(表11~14)、治疗手段的选择以及并发症的干预及转归情况。接受外科治疗的MMBD患者建议应用MSTS评分评估外科疗效,Frankel分级评估脊髓受损恢复情况,VAS评分评估疼痛水平。骨髓瘤患者应终身随访,在接受外科治疗后,除常规血液学检查外,应定期对手术部位进行影像学评估。孤立性浆细胞瘤随访和监测开始时每4周进行1次;若浆细胞瘤治疗后M蛋白完全消失,则每3~6个月进行1次,或在有临床症状时进行相关检查;如M蛋白持续存在,则继续每4周1次的监测。每6~12个月进行1次影像学检查。(1A级)



综上所述,大部分多发性骨髓瘤患者在病程中会出现骨髓瘤骨病,严重影响患者的生活质量和生存率。标准化规范化的化疗、靶向治疗和双膦酸盐是治疗多发性骨髓瘤骨病的基础和最重要的部分。局部手术在多发性骨髓瘤骨病急性并发症(病理性骨折、脊柱不稳和脊髓压迫症等)的治疗中发挥着重要作用。本次撰写的循证医学指南旨在倡导骨科和血液科医师积极开展多学科综合治疗(multidisciplinary treatment, MDT),使患者更多获益。骨科医师应提高P对MM疾病本质的认识和诊治水平,进一步降低围手术期及远期并发症。血液科医师在遇到脊柱不稳、脊髓压迫或病理性骨折等情况时应及早建议患者咨询骨科医师,接受相应外科治疗。本指南由多个相关单位的专家共同商议、集体修订完成。
参考文献(略)
——全文刊登于《中华骨与关节外科杂志》2018年4月第11卷第4期
本文作者:郭卫,牛晓辉等
本文转自:骨学周迅













