本文快捷开通转载;如有引用请注明出处。
英国东安格利亚大学(UEA) 的研究人员在眼科耗材技术方面取得了重大突破,开发了一种用于 3D 打印眼内植入物的新型树脂。这项创新可以提高用于白内障和屈光手术眼内植入物的开发及生产效率。

前言
2024年5月19日,来自英国东安格利亚大学的研究团队在「Current Eye Research 」发表研究成果「Stereolithographic Rapid Prototyping of Clear, Foldable, Non-Refractive Intraocular Lens Designs: A Proof-of-Concept Study」即「立体光刻快速成型透明、可折叠、非屈光性人工晶状体设计:概念验证研究」。研究团队成员有来自生物科学学院和药学院的研究人员。


研究介绍
2.1 背景
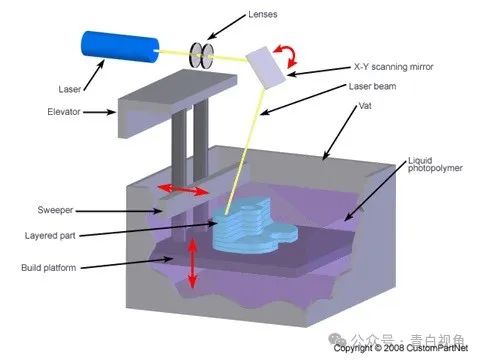
增材制造允许通过逐层沉积材料直至形成整个结构来制造在计算机辅助设计(CAD)软件上设计的物体。19,20在目前可用的不同类型的增材制造技术中,SLA 通常是制造镜片的首选方法。21该工艺有许多优点,包括高分辨率和制造速度、可使用材料的多功能性以及同时使用它们的可能性。22这些属性使 SLA 成为一种有前途的技术,可加速新型 IOL 原型的生产。
虽然之前的研究已经尝试使用增材制造技术来生产 IOL,但没有一篇研究分析过制造商用模型的结构以及对特定原型的物理化学、机械和生物特性的分析。23–25研究人员在此报告了一种通过SLA 使用内部开发的光聚合配方用于生产和表征类透镜 3D 物体的方法。使用这种材料可以生产出具有此类植入物所需机械性能的透明装置。体外测试了材料的细胞相容性,证明聚合物不会对晶状体上皮细胞引起毒性反应。因此,这项概念验证研究表明,尽管应谨慎选择适当的技术,但可以使用 SLA 所用的材料来生产类似透镜的 3D 物体。此外,还建立了一套表征技术,并适用于使用非专业设备对打印植入物进行分析。研究结果表明,在考虑将其应用于制造屈光性人工晶状体(IOL)之前,该过程还需要改进和额外的测试。然而,它仍然适合生产原型,有可能帮助研究人员开发创新的治疗植入物耗材,以应对特定的临床挑战。
总结来说,白内障作为全球主要的致盲原因,促使了人工晶状体制造技术的发展。传统的模压法和车床法虽然能够生产高质量的IOL,但在制造新设计原型时存在许多局限性。增材制造特别是SLA技术的应用,为快速、成本效益高的IOL生产提供了新的可能性。尽管目前还需要进一步研究和改进,但SLA技术有望在未来的IOL设计和生产中发挥重要作用,促进治疗植入物的创新发展。
2.2 研究内容
2.2.1 材料和方法(略)
2.2.2 结果
2.2.2.1 制作没有折射功能的类似透镜的 3D 物体原型
SLA 成功生产了以标准 IOL 设计为模型的植入式装置。使用 Blender 创建不具有折射功能的类透镜 3D 物体的 CAD 模型。该模型基于带有环形触觉的一体式 IOL;在这种情况下,光学部件的两面都是平坦的(图1)。触觉到触觉的长度为13毫米,光学直径为6毫米,厚度设定为0.9毫米。这些器件的制造采用了由丙烯酸 2-苯氧基乙酯 (POEA) 和聚乙二醇二甲基丙烯酸酯 (PEGDMA) 组成的树脂。进行了一项试点研究以优化树脂的成分。选择含有 93% (w/w) POEA 和 7% (w/w) PEGDMA 的配方来制造植入物。在这些实验中测试的所有配方中,光引发剂与树脂总质量的比例保持在额外的 1% (w/w)。
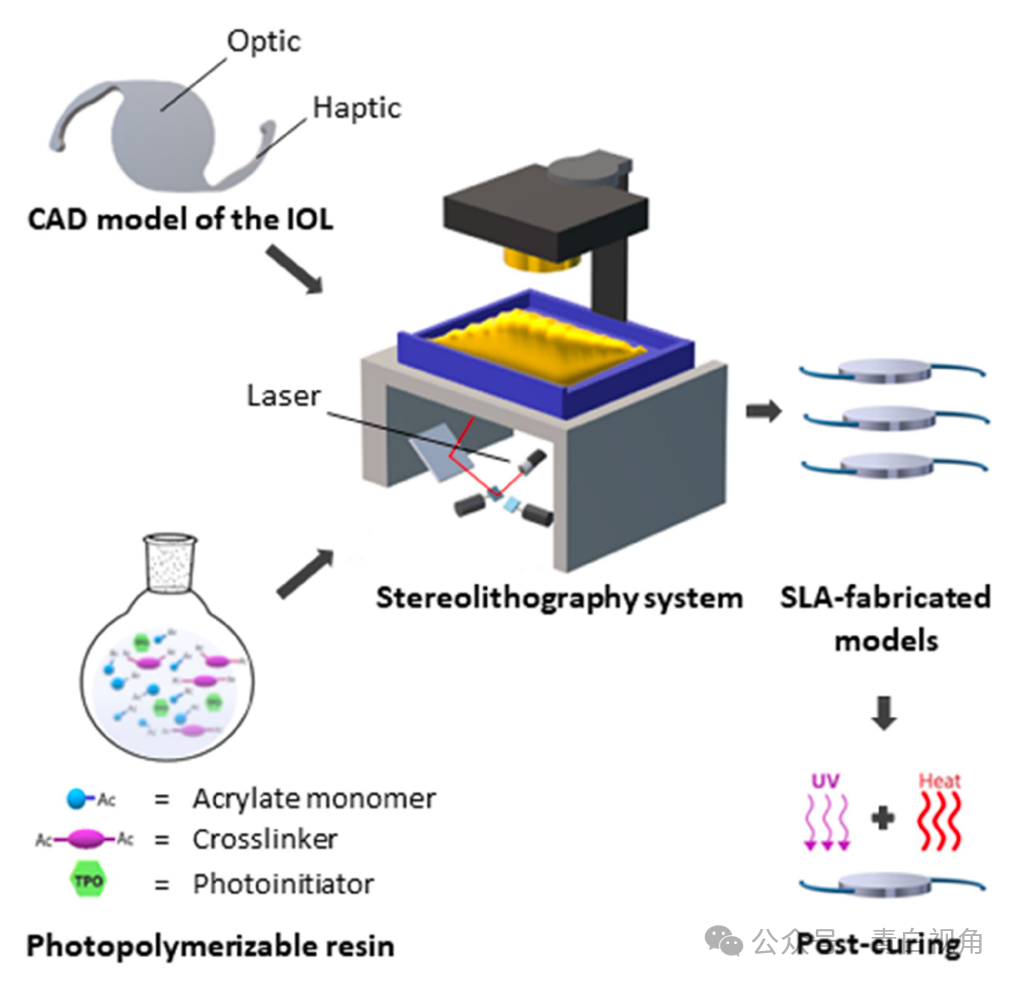
制造完成后,使用标准校准数字卡尺测量植入物的尺寸。打印器件与CAD模型的尺寸对比精度为光学直径94.5%,厚度比CAD模型理论尺寸高64%。这些数据表明,尽管该装置制造成功,但尺寸精度受到影响。
2.2.2.2后固化效率评估
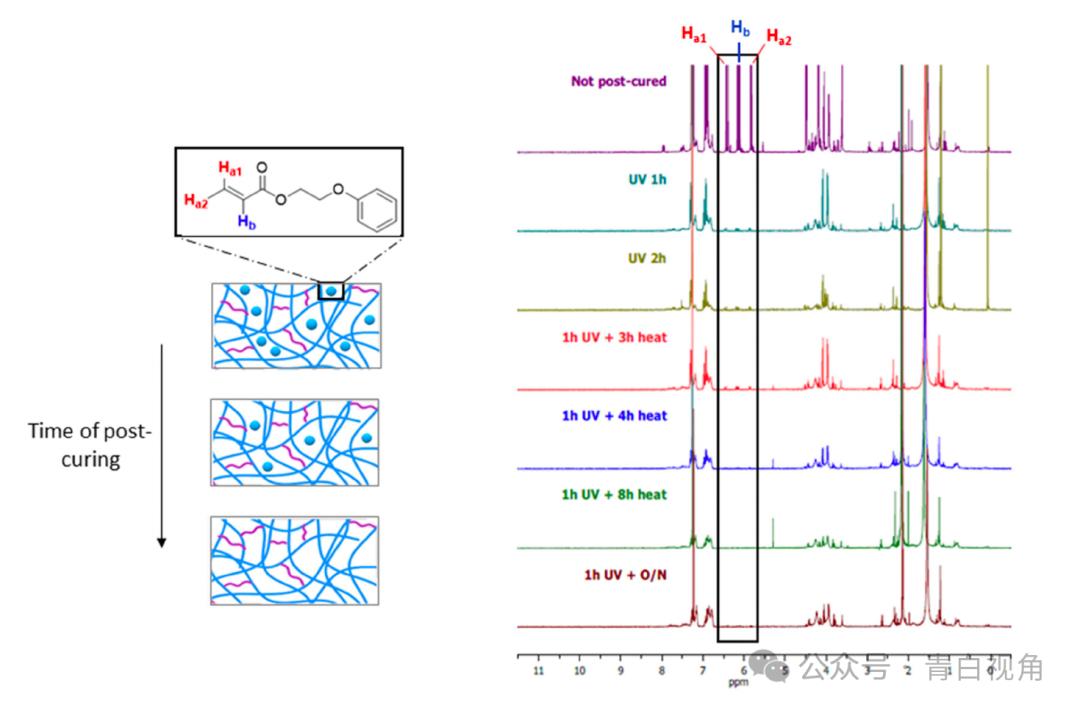
打印的器件经过后固化过程,以去除聚合物结构中残留的任何未反应的单体。通过在 d-氯仿中孵育完全或部分后固化的样品并随后使用以下方法检测浸入溶剂中的单体来监测该过程的效率:1核磁共振氢谱。该实验还用于确定聚合残余单体所需的紫外线照射和加热的最短时间。结果表明,紫外线照射1小时后,未反应分子的数量大幅减少,但随着照射时间的延长,未反应分子的数量并没有进一步减少(图2)。因此,得出的结论是,热后固化对于完成聚合物内残留单体的聚合是必要的。从光谱中可以看出,在真空中加热4小时后没有检测到单体分子。
2.2.2.3 无折射功能的类透镜 3D 物体的物理化学表征
玻璃化转变温度(时间G)的印刷聚合物通过 DSC 进行评估。根据结果(图3(A)), 这时间G形成印刷器件的交联聚合物的温度为 4.85 ± 1.09 °C,这表明该材料在室温下可能是橡胶状且柔韧的。
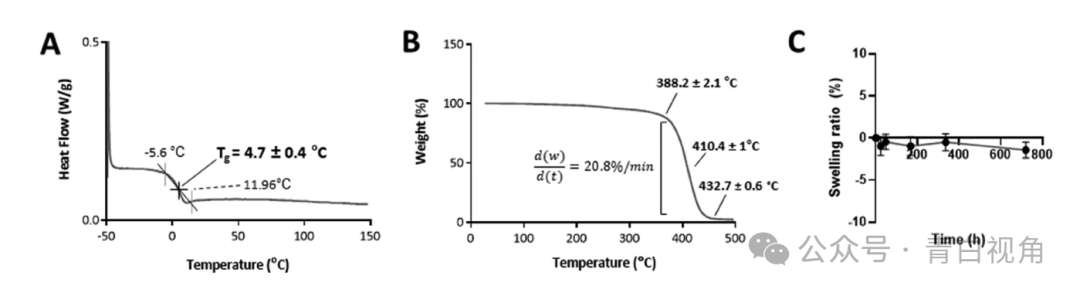
通过热重分析(TGA)评估聚合物的热稳定性。据资料显示(图3(B)),交联聚合物在〜382.4±2.17°C开始分解。降解发生在一步中,在~450°C 时完成。最后,通过体外进行膨胀测试来评估植入物在类似于房水的环境中的行为。将打印的装置在 35°C 的 PBS(pH 7.4)中孵育 1 个月,并记录不同点的重量。由于它们的重量在整个分析过程中保持恒定(图3(C)),得出的结论是,由于其高疏水性,该装置不吸收任何水。测量的高水接触角证实了这一点通过座滴技术,其平均值为 82.3 ± 3.2°。这与商业 IOL AcrySof:registered: 的水接触角相当,即 84.4 ± 0.09°。27
2.2.2.4 光学表征
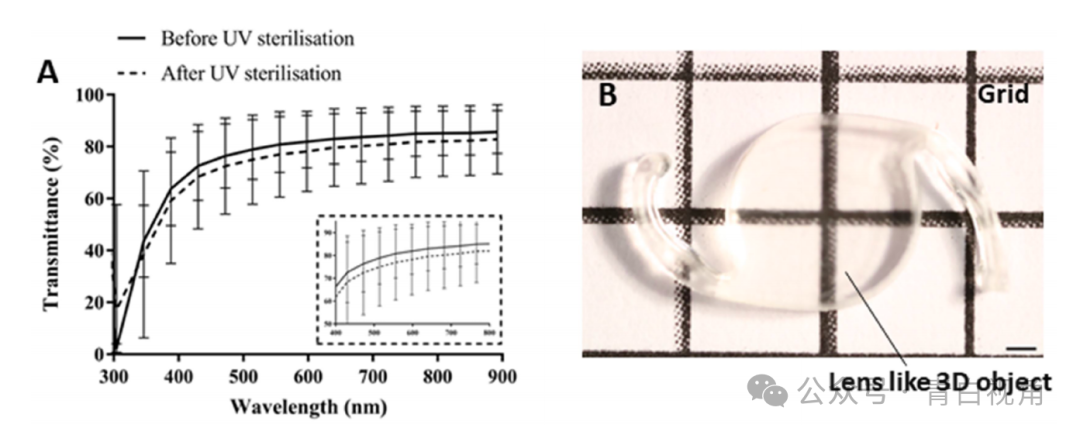
通过测量材料的光学透射率来研究打印的透镜状模型的透明度。分析结果表明,植入物透射了它们所暴露的 80-85% 的可见光(图4(A))。紫外线灭菌导致透光率下降 3%。还通过在网格线背景下对器件进行成像来评估器件的光学特性(图4(B))。这表明,根据透射率测量获得的结果,植入物相对透明并且允许网格线可视化。
2.2.2.5 机械特性
触觉拉伸强度测试表明,干燥时这些结构在与光学部件分离之前承受的力为 0.56 ± 0.07 N并且在 37°C 的 PBS 中孵育后,该值降低至 0.39 ± 0.05 N。在这两种情况下,它们均符合 ISO 11979-3 规定的 0.25 N 最小值。
2.2.2.6 形态学评价
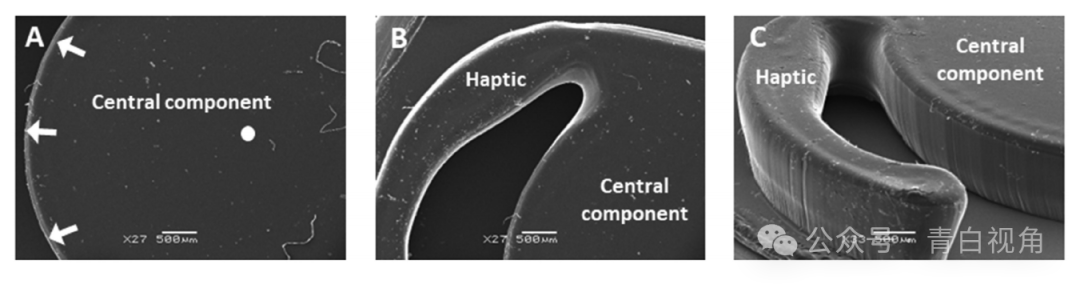
使用扫描电子显微镜(SEM)评估打印的透镜状物体的形态。装置的中心部件保持光滑的圆形形状,并且其上表面相对均匀(图5(A))。同样,也可以观察到触觉的明确定义(图5(B))。触觉部分和光学部分的垂直边缘都是平坦且一致的。然而,垂直边缘和水平表面相交的点在外观上是圆形的,没有形成尖锐的方形边缘,这是一些 IOL 制造商所青睐的特征(图5(C))。
2.2.2.7 打印植入物的生物相容性
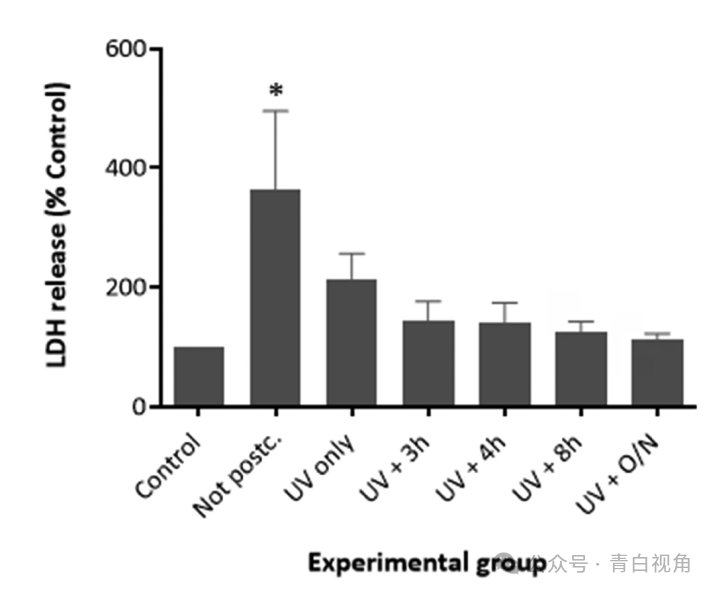
研究了后固化过程对打印类晶状体模型生物相容性的影响体外。未进行后固化或已经历不同阶段的后固化方案的样品与 FHL-124 晶状体细胞共孵育 48 小时体外。在此时间段之后,进行LDH测试。在未使用后固化聚合物孵育的细胞中检测到培养基中 LDH 浓度最高。这些水平与对照显著不同,正如方差分析和 Tukey 测试所证实的那样(p ˂0.05)。图6结果表明,当细胞在经过紫外线后固化的聚合物存在下培养时,LDH 水平显著下降。当装置在经历紫外线照射步骤后在真空中加热时,细胞死亡水平似乎进一步降低,使得细胞死亡与仅细胞对照细胞没有显著不同。还观察到热处理持续时间的增加导致植入物的毒性降低。当聚合物装置在紫外线照射后加热过夜时,检测到最低的细胞毒性。在该实验组中,细胞死亡水平与仅细胞的阴性对照相当。因此,得出的结论是,必须用紫外线照射装置 1 小时并在真空中加热过夜,以尽量减少这些装置引起的毒性。
2.2.2.8 将 SLA 制造的晶状体模型体外植入人体囊袋中
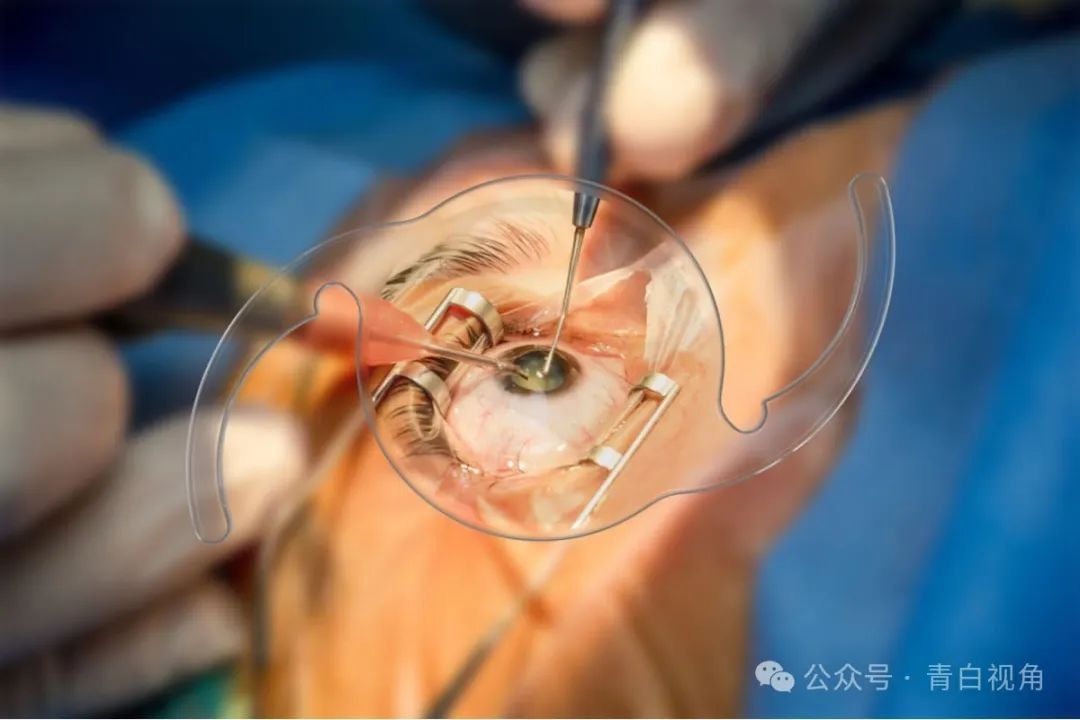
为了模拟临床情景,打印的类晶状体物体被折叠并装入IOL注射系统,然后射入含有PBS的培养皿中(图7)。注射后,折叠的植入物展开并恢复其自然形状,而不影响其结构特性。

已经证明打印设备可以通过临床工具成功递送,下一步是展示打印原型可以植入囊袋(图8)。为此,使用了人类囊袋模型。该系统通过体外进行模拟白内障手术生成。使用标准的IOL注射器成功地将一个打印的类晶状体物体植入囊袋中,且囊袋没有破裂。植入物位置居中,没有引起囊袋的异常变形。
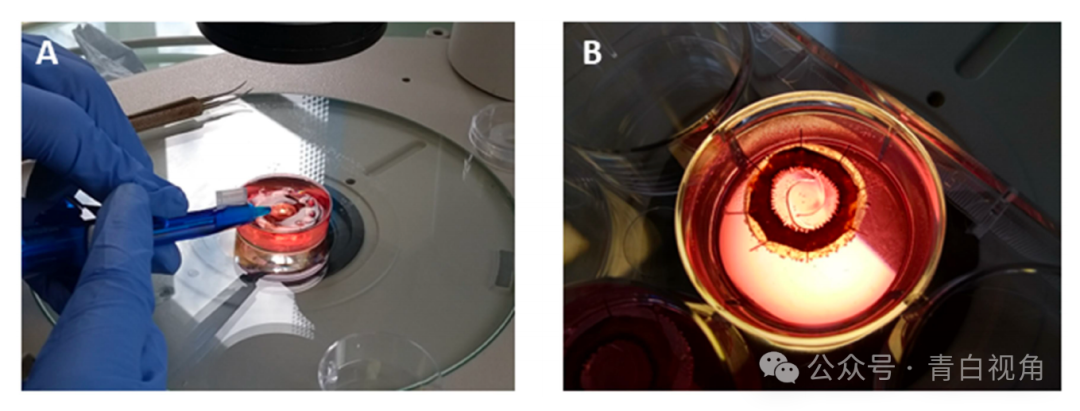
图8:数字图像显示了在体外人类囊袋模型中植入打印的类IOL装置的过程。图像(A)中可以看到植入物递送到囊袋中的过程。一旦植入囊袋,植入物恢复了其原始形状,并且没有引起囊袋的任何变形(B)。
2.2.3 讨论
虽然当前的 IOL 制造技术可以生产出高质量的产品,但原型设计和制造方法还有很大的改进空间。在当前实践中,新颖设计的生产需要制造新模具或其他专业设备,从而产生相关费用和漫长的制造时间。此外,容纳制造设备所需的大空间使得研究人员更难接近。这阻碍了新型人工晶状体的开发,其设计和材料性能的改进可以预防术后并发症。使用 SLA 快速制造 IOL 可以加速原型制作过程,从而无需模制或大量车削程序。虽然之前的研究尝试使用 SLA 来生产 IOL,但这些研究并未提供尺寸精度、机械性能和生物相容性的定量评估。因此,所得植入物的功能并未得到证实。
本研究的原理验证研究旨在展示使用 SLA 技术生产 IOL 原型,以及可打印材料形成可满足某些要求(例如生物相容性和机械强度)的 IOL 的潜力。在考虑进入其应用的进一步阶段之前,研究人员还分析了需要改进的方面。
为了演示该过程,研究人员制作了一个带有光学区域和环形触觉的标准 IOL 设计。研究人员选择 POEA 作为主要单体,PEGDMA 作为交联剂来制造类似 IOL 的植入物。POEA 是合适的,因为它是一种具有相对较高折射率 (1.52) 的芳香族单体,而 PEGDMA 是一种脂肪族双功能交联剂,可掺入混合物中以获得具有合适机械性能的原型。
一旦打印出类似人工晶状体的模型,就会研究理论尺寸和物理尺寸之间的准确性。尽管植入物的所有部件均已成功制造,但打印设备的物理尺寸与 CAD 模型的物理尺寸不同。SLA 制造的模型中心部件直径的平均精度为 94.5 ± 0.4%。然而,该器件的厚度比 CAD 模型的厚度高 64 ± 7.8%。这表明需要进一步优化来限制紫外线对树脂的穿透深度。使用构建平台有利于限制固化深度,但会导致逐层制造,从而影响物体的光学质量。然而,3D 打印行业的持续创新促进了高分辨率打印机的发展,这些打印机的功能使其与光学设备的制造更加兼容。使用此类系统制造人工晶状体,再加上本工作中报告的配方和表征方法,可以加速创建新人工晶状体原型并将其推进临床前测试阶段的过程。
接下来,研究人员对打印的透镜状物体进行后固化过程,以完成任何未反应的单体或聚合物链的聚合,因为这将提高机械强度和生物相容性。通过用紫外线照射器件并在 70°C 的真空烘箱中加热,对器件进行后固化。暴露在紫外线下会激活未反应单体和聚合物链之间化学键的形成。真空下加热加速了这一过程,同时防止了氧气产生的抑制作用。NMR 分析和 LDH 细胞毒性测试表明,确保耗尽未反应单体所需的最佳后固化时间是 UV 照射 1 小时,然后在真空烘箱中孵育过夜。细胞毒性测定表明,未经后固化的聚合物植入物引起的毒性水平显著高于阴性对照,阴性对照不包含任何与细胞接触的装置。另一方面,过夜后固化的植入物引起的细胞死亡水平显著降低,与阴性对照的细胞死亡水平相当。因此,得出的结论是,后固化方案通过消除 SLA 后残留在聚合物内的未反应单体,提高了打印设备的生物相容性。
通过进行物理化学表征来评估所制造的原型在白内障手术中的适用性。通过在35℃(人眼的温度)的水介质中进行溶胀测试来计算平衡含水量。由于其疏水性,类晶状体模型的聚合物结构不吸收任何水。这可能有利于防止某些人工晶状体中出现的反光现象,并有利于晶状体在植入囊袋后保持其尺寸。评估了设备的透明度通过光学成像并通过测量光谱透射率。这表明它们是光学透明的,尽管它们的透明度比 AcrySof :registered:人工晶状体低约 10%。28然而,值得注意的是,本生产制作没有抛光步骤。
2.3 结论
这项概念验证研究表明,SLA技术可用于直接和快速制造具有相对高精度、良好透明度、可折叠性和生物相容性的类IOL物体。本研究已经证明了可以快速原型化IOL,无需首先开发特定的IOL模具或进行复杂的车削过程。因此,这将促进创造出使用传统制造方法很难原型化的新型IOL设计。这项研究产生的模型具有光学清晰、疏水性,并且满足ISO 11979-3所建立的触觉拉力要求。体外进行的LDH分析确认了与后期固化聚合物设备接触的细胞中不存在毒性反应。本研究还展示了在体外先进人类囊袋模型中制造设备的可折叠性和可植入性。然而,需要进一步研究以提高打印分辨率,以改善尺寸准确性,另外未来需要优化的其他方面还包括工艺的可扩展性和可重复性。

评析

目前全球不少高校科研团队对3D打印人工晶体都产生了浓厚的兴趣并在积极攻关相关技术突破。如可定制化的高光学性能且人眼友好的3D打印人工晶体问世,该技术及衍生产品既可下沉市场亦可升维需求,该突破或将彻底改变目前白内障的诊疗现状。
相关参考:
1 Prokofyeva E, Wegener A, Zrenner E. Cataract prevalence and prevention in Europe: a literature review. Acta Ophthalmol. 2013;91(5):395–405. doi: 10.1111/j.1755-3768.2012.02444.x.
2 Wormstone IM, Wormstone YM, Smith AJO, Eldred JA. Posterior capsule opacification: what’s in the bag? Prog Retin Eye Res. 2021;82:100905. doi: 10.1016/j.preteyeres.2020.100905.
3 Toh T, Morton J, Coxon J, Elder MJ. Medical treatment of cataract. Clin Exp Ophthalmol. 2007;35(7):664–671. doi: 10.1111/j.1442-9071.2007.01559.x.
4 Jin C, Chen X, Law A, Kang Y, Wang X, Xu W, Yao K. Different-sized incisions for phacoemulsification in age-related cataract. Cochrane Database Syst Rev. 2017;9:CD010510.
5 Leyland M, Zinicola E. Multifocal versus monofocal intraocular lenses in cataract surgery: a systematic review. Ophthalmology. 2003;110(9):1789–1798. doi: 10.1016/S0161-6420(03)00722-X.
6 Wormstone IM, Eldred JA. Experimental models for posterior capsule opacification research. Exp Eye Res. 2016;142:2–12. doi: 10.1016/j.exer.2015.04.021.
7 Singh B, Sharma S, Bharti N, Samantrey D, Paandey DJ, Bharti S. Visual and refractive outcomes of new intraocular lens implantation after cataract surgery. Sci Rep. 2022;12(1):14100. doi: 10.1038/s41598-022-14315-6.
8 Pedrotti E, Carones F, Aiello F, Mastropasqua R, Bruni E, Bonacci E, Talli P, Nucci C, Mariotti C, Marchini G. Comparative analysis of visual outcomes with 4 intraocular lenses: monofocal, multifocal, and extended range of vision. J Cataract Refract Surg. 2018;44:156–167.
9 Bozukova D, Pagnoulle C, Jérôme R, Jérôme C. Polymers in modern ophthalmic implants—historical background and recent advances. Mater Sci Eng R Rep. 2010;69(6):63–83. doi: 10.1016/j.mser.2010.05.002.
10 Luo C, Wang H, Chen X, Xu J, Yin H, Yao K. Recent advances of intraocular lens materials and surface modification in cataract surgery. Front Bioeng Biotechnol. 2022;10:913383. doi: 10.3389/fbioe.2022.913383.
11 Olson RJ, Werner L, Mamalis N, Cionni R. New intraocular lens technology. Am J Ophthalmol. 2005;140(4):709–716. doi: 10.1016/j.ajo.2005.03.061.
12 Kumari R, Srivastava M, Garg P, Janardhanan R. Intra ocular lens technology–a review of journey from its inception. Ophthalmol Res. 2020;11:1–9. doi: 10.9734/or/2019/v11i330129.
13 Yu N, Fang F, Wu B, Zeng L, Cheng Y. State of the art of intraocular lens manufacturing. Int J Adv Manuf Technol. 2018;98(5–8):1103–1130. doi: 10.1007/s00170-018-2274-5.
14 Yildirim TM, Fang H, Schickhardt SK, Wang Q, Merz PR, Auffarth GU. Glistening formation in a new hydrophobic acrylic intraocular lens. BMC Ophthalmol. 2020;20(1):186. doi: 10.1186/s12886-020-01430-z.
15 Weinschenk JIIII, Deacon J, Sussman GR. Method of producing repositionable intraocular lenses. United States Patent 5,567,365. Allergan, Inc.; 1996. https://patents.justia.com/inventor/joseph-i-weinschenk?page=3.
16 Tripti D, Haldar RS, Geetha S, Niyogi UK, Khandal RK. Materials for intraocular lenses (IOLs): review of developments to achieve biocompatibility. e-Polymers. 2009;9(1). doi: 10.1515/epoly.2009.9.1.1466.
17 Glick RE, Deacon J, Kent BW. Cast molding of intraocular lenses. United States Patent 5,620,720. Allergan, Inc.; 1997.
18 Sarbadhikari KK. Intraocular lens manufacturing apparatus. United States Patent 6,732,994 B2. Bausch & Lomb Incorporated; 2004.
19 Selimis A, Mironov V, Farsari M. Direct laser writing: principles and materials for scaffold 3D printing. Microelectron Eng. 2015;132:83–89. doi: 10.1016/j.mee.2014.10.001.
20 Wang X, Jiang M, Zhou Z, Gou J, Hui D. 3D printing of polymer matrix composites: a review and prospective. Compos Part B Eng. 2017;110:442–458. doi: 10.1016/j.compositesb.2016.11.034.
21 Sun Q, Fang F, Wang W, Yin J, Liu Q, Hao L, Peng Y. Stereolithography 3D printing of transparent resin lens for high-power phosphor-coated WLEDs packaging. J Manuf Process. 2023;85:756–763. doi: 10.1016/j.jmapro.2022.11.026.
22 Chartrain NA, Williams CB, Whittington AR. A review on fabricating tissue scaffolds using vat photopolymerization. Acta Biomater. 2018;74:90–111. doi: 10.1016/j.actbio.2018.05.010.
23 Debellemanière G, Flores M, Montard M, Delbosc B, Saleh M. Three-dimensional printing of optical lenses and ophthalmic surgery: challenges and perspectives. J Refract Surg. 2016;32(3):201–204. doi: 10.3928/1081597X-20160121-05.
24 Li JW, Li YJ, Hu XS, Gong Y, Xu BB, Xu HW, Yin ZQ. Biosafety of a 3D-printed intraocular lens made of a poly(acrylamide-co-sodium acrylate) hydrogel in vitro and in vivo. Int J Ophthalmol. 2020;13(10):1521–1530. doi: 10.18240/ijo.2020.10.03.
25 Kumagai H, Arai M, Gong J, Sakai K, Kawakami M, Furukawa H. Modeling the transparent shape memory gels by 3D printer Acculas. SPIE; 2016. https://www.spiedigitallibrary.org/conference-proceedings-of-spie/9802/1/Modeling-the-transparent-shape-memory-gels-by-3D-printer-Acculas/10.1117/12.2218236.short.
26 Liu CS, Wormstone IM, Duncan G, Marcantonio JM, Webb SF, Davies PD. A study of human lens cell growth in vitro. A model for posterior capsule opacification. Invest Ophthalmol Visual Sci. 1996;37:906–914.
27 Jung GB, Jin K-H, Park H-K. Physicochemical and surface properties of acrylic intraocular lenses and their clinical significance. J Pharm Investig. 2017;47(5):453–460. doi: 10.1007/s40005-017-0323-y.
28 Li X, Kelly D, Nolan JM, Dennison JL, Beatty S. The evidence informing the surgeon’s selection of intraocular lens on the basis of light transmittance properties. Eye. 2017;31(2):258–272. doi: 10.1038/eye.2016.266.
声明:本文转载于<青白视角>,以上仅代表作者本人观点,仅用于学习交流,版权归原作者所有。













