概述
一
定义和分类
骨质疏松症(osteoporosis, OP)是最常见的骨骼疾病, 是一种以骨量低,骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病。2001年美国国立卫生研究院(National Institutes of Health, NIH)将其定义为以骨强度下降和骨折风险增加为特征的骨骼疾病,提示骨量降低是骨质疏松性骨折的主要危险因素,但还存在其他危险因素。骨质疏松症可发生于任何年龄,但多见于绝经后女性和老年男性。骨质疏松症分为原发性和继发性两大类。原发性骨质疏松症包括绝经后骨质疏松症(Ⅰ型)、老年骨质疏松症(Ⅱ型)和特发性骨质疏松症(包括青少年型)。绝经后骨质疏松症一般发生在女性绝经后5~10年内;老年骨质疏松症一般指70岁以后发生的骨质疏松;特发性骨质疏松症主要发生在青少年,病因尚未明。继发性骨质疏松症指由任何影响骨代谢的疾病和/或药物及其他明确病因导致的骨质疏松。本指南主要针对原发性骨质疏松症。
二
流行病学
骨质疏松症是一种与增龄相关的骨骼疾病。目前我国60岁以上人口已超过2.1亿(约占总人口的15.5%),65岁以上人口近1.4亿(约占总人口的10.1%),是世界上老年人口绝对数最大的国家。随着人口老龄化日趋严重,骨质疏松症已成为我国面临的重要公共健康问题。早期流行病学调查显示:我国50岁以上人群骨质疏松症患病率女性为20.7%,男性为14.4%;60岁以上人群骨质疏松症患病率明显增高,女性尤为突出。据估算2006年我国骨质疏松症患者近7 000万,骨量减少者已超过2亿人。尽管缺乏新近的流行病学数据,但估测我国骨质疏松症和骨量减少人数已远超过以上数字。
骨质疏松性骨折(或称脆性骨折)指受到轻微创伤或日常活动中即发生的骨折, 是骨质疏松症的严重后果。骨质疏松性骨折的常见部位是椎体、髋部、前臂远端、肱骨近端和骨盆等,其中最常见的是椎体骨折。国内基于影像学的流行病学调查显示,50岁以上女性椎体骨折患病率约为15%,50岁以后椎体骨折的患病率随增龄而渐增,80岁以上女性椎体骨折患病率可高达36.6%。髋部骨折是最严重的骨质疏松性骨折,近年来我国髋部骨折的发生率呈显著上升趋势。研究表明:1990-1992年间,50岁以上髋部骨折发生率男性为83/10万,女性为80/10万;2002-2006年间,此发生率增长为男性129/10万和女性229/10万,分别增加了1.61倍和2.76倍。预计在未来几十年中国人髋部骨折发生率仍将处于增长期。据估计,2015年我国主要骨质疏松性骨折(腕部、椎体和髋部)约为269万例次,2035年约为483万例次,到2050年约达599万例次。女性一生发生骨质疏松性骨折的危险性(40%)高于乳腺癌、子宫内膜癌和卵巢癌的总和,男性一生发生骨质疏松性骨折的危险性(13%)高于前列腺癌。
骨质疏松性骨折的危害巨大,是老年患者致残和致死的主要原因之一。发生髋部骨折后1年之内,20%患者会死于各种并发症,约50%患者致残,生活质量明显下降。而且,骨质疏松症及骨折的医疗和护理,需要投入大量的人力、物力和财力,造成沉重的家庭和社会负担。据2015年预测,我国2015、2035和2050年用于主要骨质疏松性骨折(腕部、椎体和髋部)的医疗费用将分别高达720亿元、1320亿元和1630亿元。
然而,必须强调骨质疏松症可防、可治。需加强对危险人群的早期筛查与识别,即使已经发生过脆性骨折的患者,经过适当的治疗,可有效降低再次骨折的风险。目前我国骨质疏松症诊疗率在地区间、城乡间还存在显著差异,整体诊治率均较低。即使患者发生了脆性骨折(椎体骨折和髋部骨折),骨质疏松症的诊断率仅为2/3左右,接受有效抗骨质疏松药物治疗者尚不足1/4。鉴于我国目前骨质疏松症诊治率过低的严峻现实,本指南建议在医疗卫生工作中重视骨质疏松症及其骨折的防治,注意识别高危人群,给予及时诊断和合理治疗。
概述
骨质疏松的发病机制
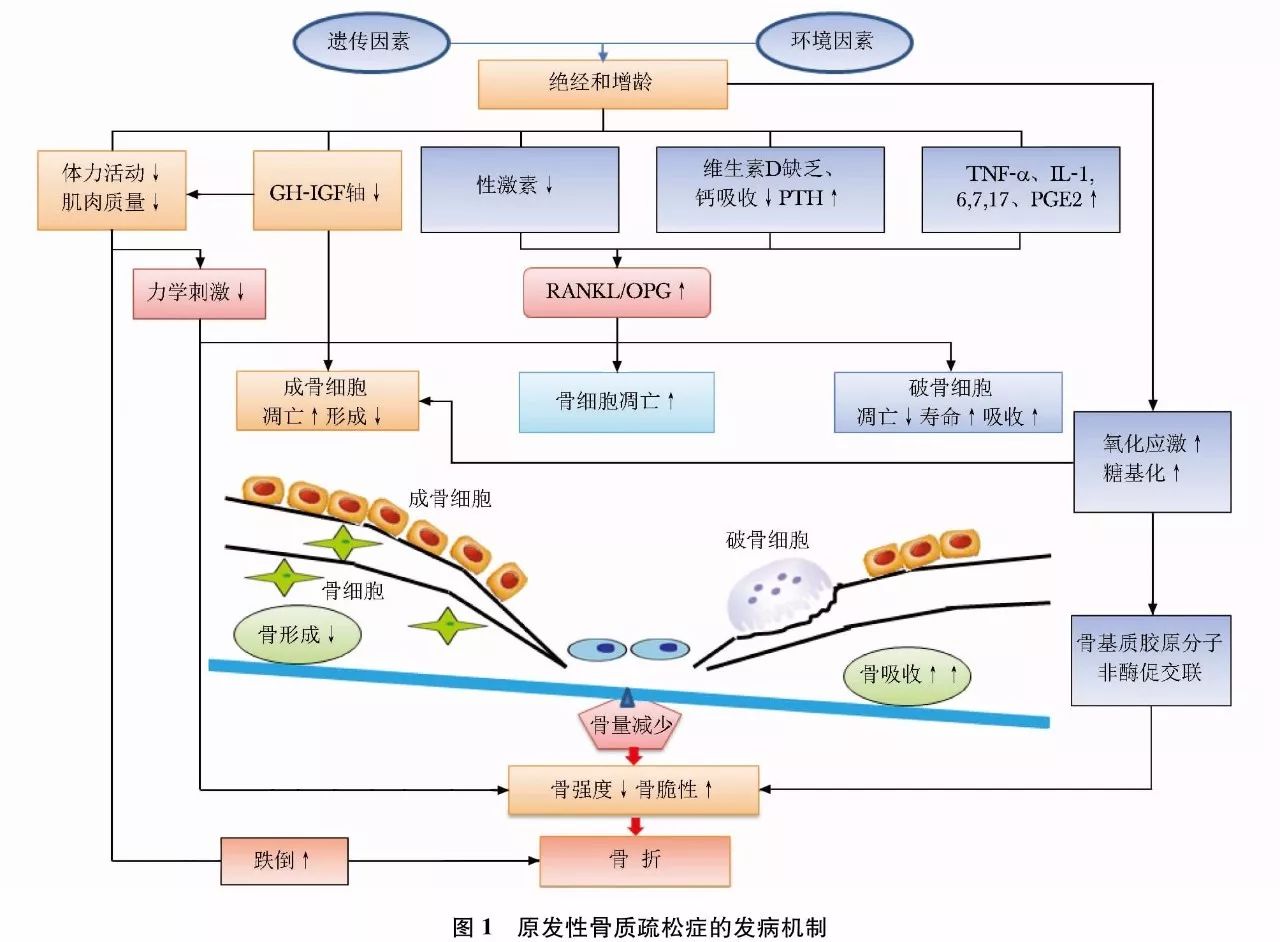
骨骼需有足够的刚度和韧性维持骨强度,以承载外力,避免骨折。为此,要求骨骼具备完整的层级结构,包括Ⅰ型胶原的三股螺旋结构、非胶原蛋白及沉积于其中的羟基磷灰石。骨骼的完整性由不断重复、时空偶联的骨吸收和骨形成过程维持,此过程称为“骨重建”。骨重建由成骨细胞、破骨细胞和骨细胞等组成的骨骼基本多细胞单位(basic multicellular unit, BMU)实施。成年前骨骼不断构建、塑形和重建,骨形成和骨吸收的正平衡使骨量增加,并达到骨峰值;成年期骨重建平衡,维持骨量;此后随年龄增加,骨形成与骨吸收呈负平衡,骨重建失衡造成骨丢失。
适当的力学刺激和负重有利于维持骨重建,修复骨骼微损伤,避免微损伤累积和骨折。分布于哈佛管周围的骨细胞(占骨骼细胞的90%~95%)可感受骨骼的微损伤和力学刺激,并直接与邻近骨细胞,或通过内分泌、自分泌和旁分泌的方式与其他骨细胞联系。力学刺激变化或微损伤贯通板层骨或微管系统,通过影响骨细胞的信号转导,诱导破骨细胞前体的迁移和分化。破骨细胞占骨骼细胞的1%~2%,由单核巨噬细胞前体分化形成,主司骨吸收。破骨细胞生成的关键调节步骤包括成骨细胞产生的核因子-κB受体活化体配体[receptor activator of nuclear factor-κB (NF-κB) ligand,RANKL]与破骨细胞前体细胞上的RANK结合,从而激活NF-κB,促进破骨细胞分化。破骨细胞的增生和生存有赖于成骨细胞源性的巨噬细胞集落刺激因子(macro-phage colony-stimulating factor, M-CSF)与破骨细胞的受体c-fms相结合。成骨细胞分泌的护骨素(osteoprotegerin,OPG),也作为可溶性RANKL的受体,与RANK竞争性结合RANKL,从而抑制破骨细胞的生成。RANKL/OPG的比值决定了骨吸收的程度,该比值受甲状旁腺素(parathyroid hormone,PTH)、1, 25双羟维生素D[1, 25-dihydroxyvitamin D, 1, 25(OH)2D]、前列腺素和细胞因子等的影响。骨吸收后,成骨细胞的前体细胞能感知转化生长因子-β1(transforming growth factor-β1, TGF-β1) 的梯度变化而被募集。成骨细胞由间充质干细胞分化而成,主司骨形成,并可随骨基质的矿化而成为包埋于骨组织中的骨细胞或停留在骨表面的骨衬细胞。成骨细胞分泌富含蛋白质的骨基质,包括Ⅰ型胶原和一些非胶原的蛋白质(如骨钙素)等;再经过数周至数月,羟基磷灰石沉积于骨基质上完成矿化。
绝经后骨质疏松症主要是由于绝经后雌激素水平降低,雌激素对破骨细胞的抑制作用减弱,破骨细胞的数量增加、凋亡减少、寿命延长,导致其骨吸收功能增强。尽管成骨细胞介导的骨形成亦有增加,但不足以代偿过度骨吸收,骨重建活跃和失衡致使小梁骨变细或断裂,皮质骨孔隙度增加,导致骨强度下降。雌激素减少降低骨骼对力学刺激的敏感性,使骨骼呈现类似于废用性骨丢失的病理变化。
老年性骨质疏松症一方面由于增龄造成骨重建失衡,骨吸收/骨形成比值升高,导致进行性骨丢失;另一方面,增龄和雌激素缺乏使免疫系统持续低度活化,处于促炎性反应状态。炎性反应介质肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白介素(interleukin,IL)-1、IL-6、IL-7、IL-17及前列腺素E2(prostaglandin E2, PGE2) 均诱导M-CSF和RANKL的表达,刺激破骨细胞,并抑制成骨细胞,造成骨量减少。雌激素和雄激素在体内均具有对抗氧化应激的作用,老年人性激素结合球蛋白持续增加,使睾酮和雌二醇的生物利用度下降,体内的活性氧类(reactive oxidative species,ROS)堆积,促使间充质干细胞、成骨细胞和骨细胞凋亡,使骨形成减少。老年人常见维生素D缺乏及慢性负钙平衡,导致继发性甲状旁腺功能亢进。年龄相关的肾上腺源性雄激素生成减少、生长激素-胰岛素样生长因子轴功能下降、肌少症和体力活动减少造成骨骼负荷减少,也会使骨吸收增加。此外,随增龄和生活方式相关疾病引起的氧化应激及糖基化增加,使骨基质中的胶原分子发生非酶促交联,也会导致骨强度降低。
骨质疏松症及其骨折的发生是遗传因素和非遗传因素交互作用的结果(图1)。遗传因素主要影响骨骼大小、骨量、结构、微结构和内部特性。峰值骨量的60%至80%由遗传因素决定,多种基因的遗传变异被证实与骨量调节相关。非遗传因素主要包括环境因素、生活方式、疾病、药物、跌倒相关因素等。骨质疏松症是由多种基因-环境因素等微小作用积累的共同结果。
骨质疏松症危险因素及风险评估
一
骨质疏松症危险因素
骨质疏松症是一种受多重危险因素影响的复杂疾病,危险因素包括遗传因素和环境因素等多方面。骨折是骨质疏松症的严重后果,也有多种骨骼外的危险因素与骨折相关。因此,临床上需注意识别骨质疏松症及其并发症骨折的危险因素,筛查高危人群,尽早诊断和防治骨质疏松症,减少骨折的发生。
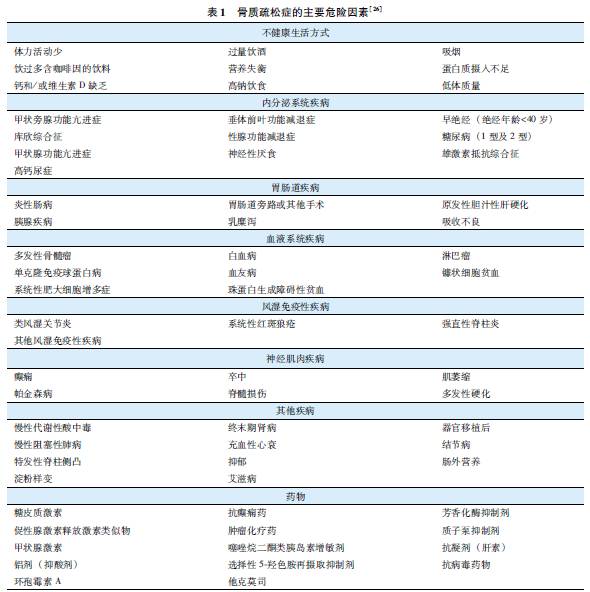
骨质疏松症的危险因素分为不可控因素与可控因素,后者包括不健康生活方式、疾病、药物等(表1)。
1. 不可控因素
主要有种族(患骨质疏松症的风险:白种人高于黄种人,而黄种人高于黑种人)、老龄化、女性绝经、脆性骨折家族史。
2. 可控因素
不健康生活方式:包括体力活动少、吸烟、过量饮酒、过多饮用含咖啡因的饮料、营养失衡、蛋白质摄入过多或不足、钙和/或维生素D缺乏、高钠饮食、体质量过低等。
影响骨代谢的疾病:包括性腺功能减退症等多种内分泌系统疾病、风湿免疫性疾病、胃肠道疾病、血液系统疾病、神经肌肉疾病、慢性肾脏及心肺疾病等。
影响骨代谢的药物:包括糖皮质激素、抗癫痫药物、芳香化酶抑制剂、促性腺激素释放激素类似物、抗病毒药物、噻唑烷二酮类药物、质子泵抑制剂和过量甲状腺激素等。
二
骨质疏松症风险评估工具
骨质疏松症是受多因素影响的复杂疾病,对个体进行骨质疏松症风险评估,能为疾病早期防治提供有益帮助。临床上评估骨质疏松风险的方法较多,这里推荐国际骨质疏松基金会(International Osteoporosis Foundation, IOF)骨质疏松风险一分钟测试题和亚洲人骨质疏松自我筛查工具(osteoporosis self-assessment tool for Asians, OSTA),作为疾病风险的初筛工具。
1. IOF骨质疏松风险一分钟测试题
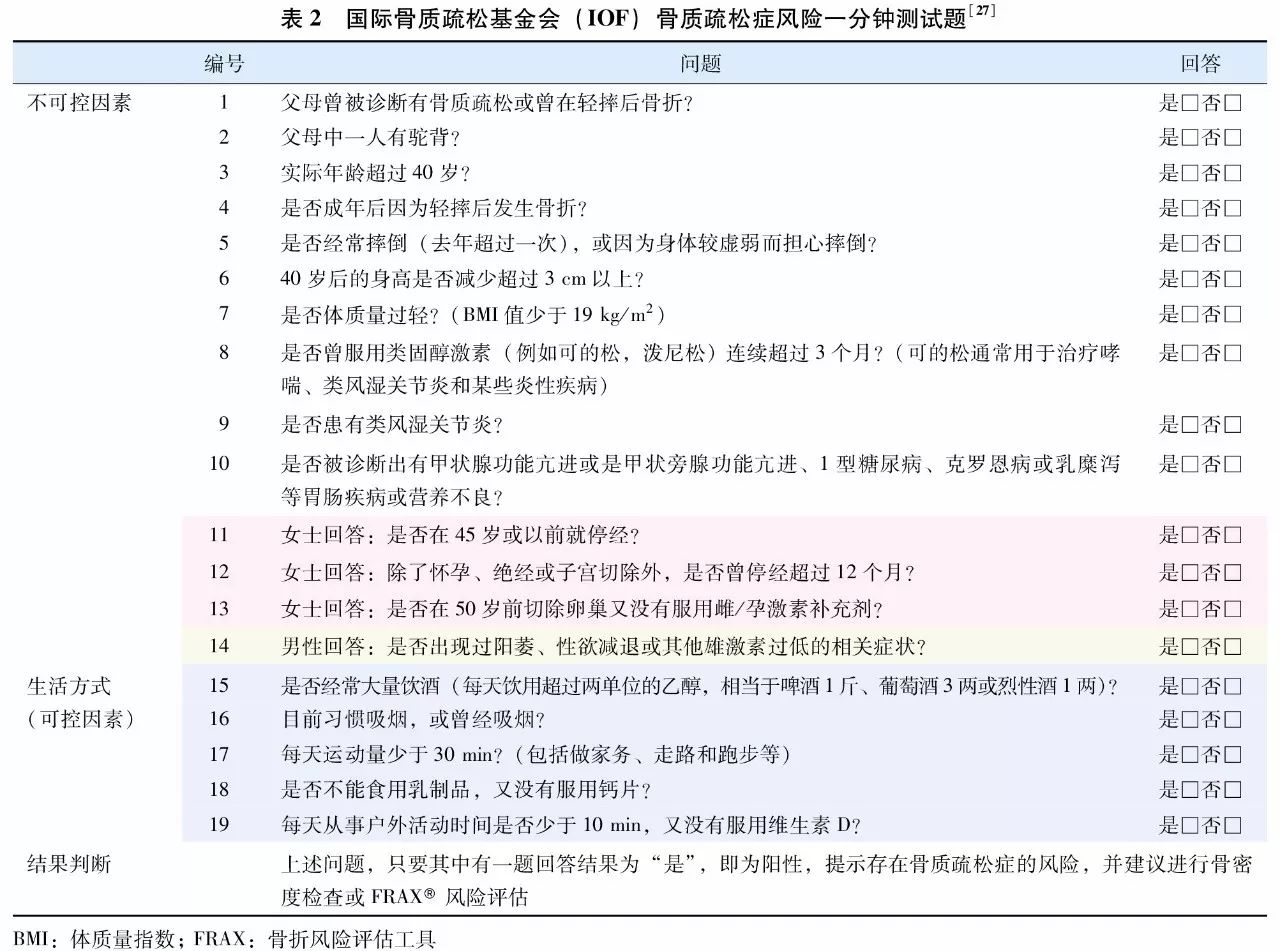
IOF骨质疏松风险一分钟测试题是根据患者简单病史,从中选择与骨质疏松相关的问题,由患者判断是与否,从而初步筛选出可能具有骨质疏松风险的患者。该测试题简单快速,易于操作,但仅能作为初步筛查疾病风险,不能用于骨质疏松症的诊断,具体测试题见(表2)。
2. 亚洲人骨质疏松自我筛查工具
OSTA基于亚洲8个国家和地区绝经后妇女的研究,收集多项骨质疏松危险因素,并进行骨密度测定,从中筛选出11项与骨密度显著相关的危险因素,再经多变量回归模型分析,得出能较好体现敏感度和特异度的两项简易筛查指标,即年龄和体质量。计算方法是:
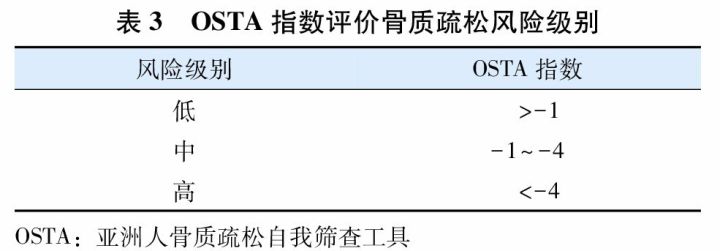
OSTA指数=[体质量(kg)-年龄(岁)]×0.2,结果评定见(表3)。也可以通过简图(图2)根据年龄和体质量进行快速查对评估。
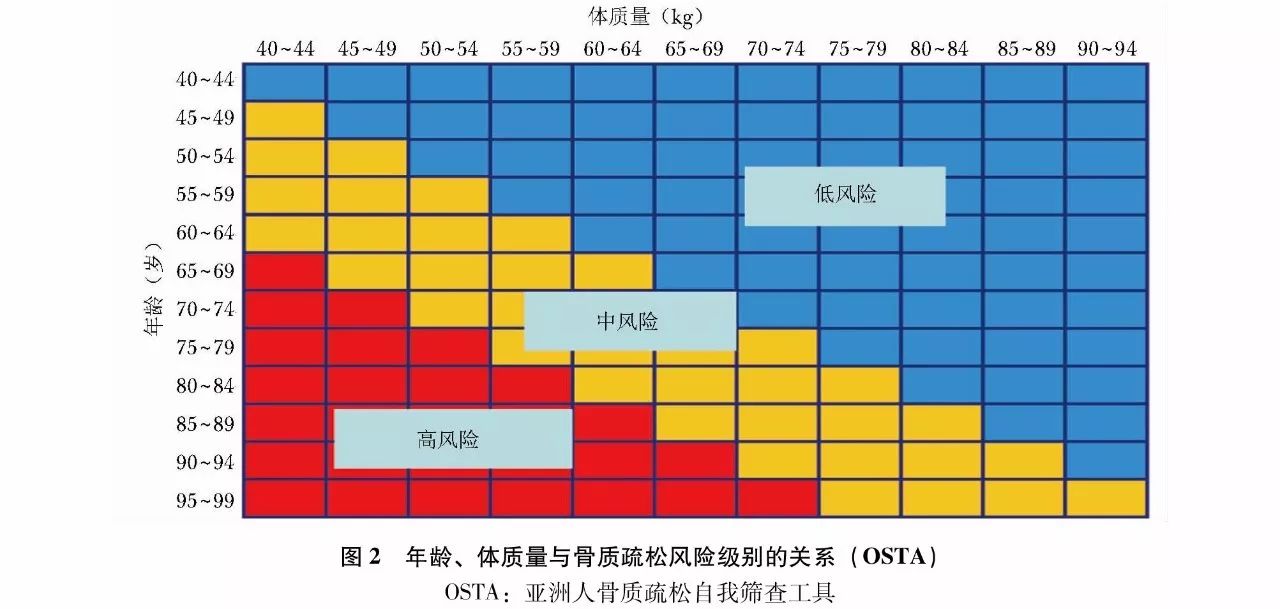
OSTA主要是根据年龄和体质量筛查骨质疏松症的风险,但需要指出,OSTA所选用的指标过少,其特异性不高,需结合其他危险因素进行判断,且仅适用于绝经后妇女。
3. 骨质疏松性骨折的风险预测
世界卫生组织(World Health Organization ,WHO)推荐的骨折风险预测工具(fracture risk assessment tool, FRAX®),根据患者的临床危险因素及股骨颈骨密度建立模型,用于评估患者未来10年髋部骨折及主要骨质疏松性骨折(椎体、前臂、髋部或肩部)的概率。针对中国人群的FRAX®可通过登陆以下网址获得:http://www.sheffield.ac.uk/FRAX/tool.aspx?country=2。]]>
FRAX® 工具的计算参数主要包括部分临床危险因素和股骨颈骨密度(表4)。FRAX® 工具应用中存在的问题与局限:

(1) 应用人群:不需FRAX®评估者:临床上已诊断骨质疏松症(即骨密度T-值≤-2.5) 或已发生脆性骨折者,不必再用FRAX®评估骨折风险,应及时开始治疗。
需要FRAX®评估风险者:具有一个或多个骨质疏松性骨折临床危险因素,未发生骨折且骨量减少者(骨密度为T-值-1.0~-2.5),可通过FRAX®计算患者未来10年发生主要骨质疏松性骨折及髋部骨折的概率。对于FRAX®评估阈值为骨折高风险者,建议进行骨密度测量,并考虑给予治疗。
FRAX®工具不适于已接受有效抗骨质疏松药物治疗的人群。
(2) 地区、人种差异问题:FRAX®的骨折相关危险因素基于来自欧洲、北美、亚洲、澳大利亚等多个独立大样本前瞻性人群研究和大样本的荟萃分析,因此有一定的代表性。由于针对我国骨质疏松性骨折发病率及其影响因素的大样本流行病学研究正在进行中,初步研究提示目前FRAX®预测结果可能低估了中国人群的骨折风险。
(3) 判断是否需要治疗的阈值:建议给予患者治疗的FRAX®阈值,尚存争议,有研究认为不同国家、性别、不同年龄段应有不同的干预阈值。美国指南建议FRAX®预测的髋部骨折概率≥3%或任何主要骨质疏松性骨折概率≥20%时,为骨质疏松性骨折高危患者,建议给予治疗;而欧洲部分国家建议FRAX®预测的髋部骨折概率≥5%为治疗阈值。鉴于FRAX®可能低估中国人群的骨折风险,本指南建议FRAX®预测的髋部骨折概率≥3%或任何主要骨质疏松性骨折概率≥20%时,为骨质疏松性骨折高危患者,建议给予治疗。
(4) FRAX®的其他不足:除FRAX®包括的骨折危险因素,还有其他因素也与骨折发生相关。如跌倒是诱发骨折的重要危险因素,但FRAX®计算中没有包括跌倒。FRAX®的危险因素纳入了糖皮质激素使用史,但没有涉及糖皮质激素的治疗剂量及疗程。FRAX®也没有纳入与骨质疏松症相关的多种其他药物。FRAX®尽管列入了部分与骨质疏松症相关的疾病,包括类风湿关节炎、糖尿病、成骨不全症等,但有待进一步完善。
4. 跌倒及其危险因素
跌倒是骨质疏松性骨折的独立危险因素,跌倒的危险因素包括环境因素和自身因素等,应重视对下列跌倒相关危险因素的评估及干预。
环境因素:包括光线昏暗、路面湿滑、地面障碍物、地毯松动、卫生间未安装扶手等。
自身因素:包括年龄老化、肌少症、视觉异常、感觉迟钝、神经肌肉疾病、缺乏运动、平衡能力差、步态异常、既往跌倒史、维生素D不足、营养不良、心脏疾病、体位性低血压、抑郁症、精神和认知疾患、药物(如安眠药、抗癫痫药及治疗精神疾病药物)等。
骨质疏松症临床表现
骨质疏松症初期通常没有明显的临床表现,因而被称为“寂静的疾病”或“静悄悄的流行病”。但随着病情进展,骨量不断丢失,骨微结构破坏,患者会出现骨痛,脊柱变形,甚至发生骨质疏松性骨折等后果。部分患者可没有临床症状,仅在发生骨质疏松性骨折等严重并发症后才被诊断为骨质疏松症。
(一)疼痛
骨质疏松症患者,可出现腰背疼痛或全身骨痛。疼痛通常在翻身时、起坐时及长时间行走后出现,夜间或负重活动时疼痛加重,并可能伴有肌肉痉挛,甚至活动受限。
(二)脊柱变形
严重骨质疏松症患者,因椎体压缩性骨折,可出现身高变矮或驼背等脊柱畸形。多发性胸椎压缩性骨折可导致胸廓畸形,甚至影响心肺功能;严重的腰椎压缩性骨折可能会导致腹部脏器功能异常,引起便秘、腹痛、腹胀、食欲减低等不适。
(三)骨折
骨质疏松性骨折属于脆性骨折,通常指在日常生活中受到轻微外力时发生的骨折。骨折发生的常见部位为椎体(胸、腰椎),髋部(股骨近端),前臂远端和肱骨近端;其他部位如肋骨、跖骨、腓骨、骨盆等部位亦可发生骨折。骨质疏松性骨折发生后,再骨折的风险显著增加。
(四)对心理状态及生活质量的影响
骨质疏松症及其相关骨折对患者心理状态的危害常被忽略,主要的心理异常包括恐惧、焦虑、抑郁、自信心丧失等。老年患者自主生活能力下降,以及骨折后缺少与外界接触和交流,均会给患者造成巨大的心理负担。应重视和关注骨质疏松症患者的心理异常,并给予必要的治疗。
骨质疏松症诊断及鉴别诊断
骨质疏松症的诊断基于全面的病史采集、体格检查、骨密度测定、影像学检查及必要的生化测定。临床上诊断原发性骨质疏松症应包括两方面:确定是否为骨质疏松症和排除继发性骨质疏松症。
一
常用的骨密度及测量方法
骨密度是指单位体积(体积密度)或者是单位面积(面积密度)所含的骨量。骨密度及骨测量方法较多,不同方法在骨质疏松症的诊断、疗效监测以及骨折危险性评估中的作用有所不同。目前临床和科研常用的骨密度测量方法有双能X线吸收检测法(dual energy X-ray absorptiometry, DXA)、定量计算机断层照相术(quantitative computed tomography, QCT)、外周QCT(peripheral quantita-tive computed tomography, pQCT)和定量超声(quantitative ultrasound, QUS)等。目前公认的骨质疏松症诊断标准是基于DXA测量的结果。
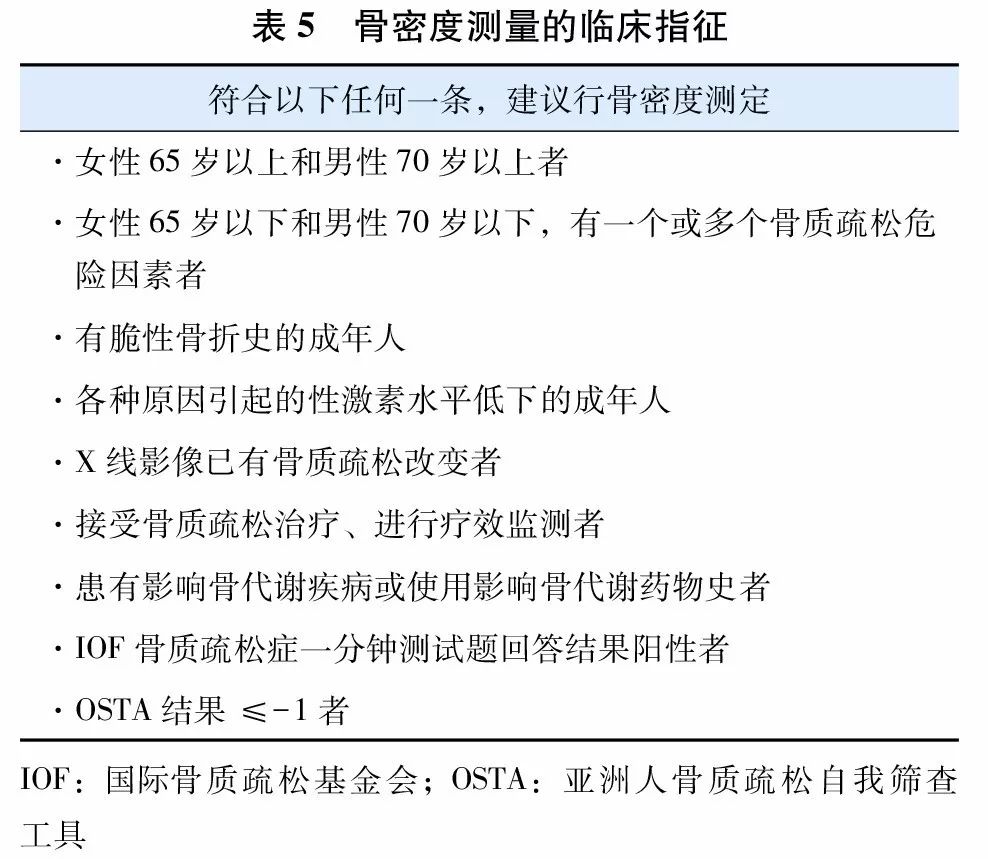
我国已经将骨密度检测项目纳入40岁以上人群常规体检内容,临床上为诊治骨质疏松症的骨密度测定指征见(表5)。
1. DXA检测骨密度
DXA骨密度测量是临床和科研最常用的骨密度测量方法,可用于骨质疏松症的诊断、骨折风险性预测和药物疗效评估,也是流行病学研究常用的骨骼评估方法。其主要测量部位是中轴骨,包括:腰椎和股骨近端,如腰椎和股骨近端测量受限,可选择非优势侧桡骨远端1/3(33%)。DXA正位腰椎测量感兴趣区包括椎体及其后方的附件结构,故其测量结果受腰椎的退行性改变(如椎体和椎小关节的骨质增生硬化等)和腹主动脉钙化影响。DXA股骨近端测量感兴趣区分别为股骨颈、大粗隆、全髋和Wards三角区的骨密度,其中用于骨质疏松症诊断感兴趣区是股骨颈和全髋。另外,不同DXA机器的测量结果如未行横向质控,不能相互比较。新型DXA测量仪所采集的胸腰椎椎体侧位影像,可用于椎体形态评估及其骨折判定(vertebral fracture assessment, VFA)。
2. 定量CT
QCT是在CT设备上,应用已知密度的体模(phantom)和相应的测量分析软件测量骨密度的方法。该方法可分别测量松质骨和皮质骨的体积密度,可较早地反映骨质疏松早期松质骨的丢失状况。QCT通常测量的是腰椎和/或股骨近端的松质骨骨密度。QCT腰椎测量结果预测绝经后妇女椎体骨折风险的能力类似于DXA腰椎测量的评估。QCT测量也可用于骨质疏松药物疗效观察。
3. 外周骨定量CT
pQCT测量部位多为桡骨远端和胫骨。该部位测量结果主要反映的是皮质骨骨密度,可用于评估绝经后妇女髋部骨折的风险。因目前无诊断标准,尚不能用于骨质疏松的诊断及临床药物疗效判断。另外,高分辨pQCT除测量骨密度外,还可显示骨微结构及计算骨力学性能参数。
4. 定量超声
QUS定量超声测量的主要是感兴趣区(包括软组织、骨组织、骨髓组织)结构对声波的反射和吸收所造成超声信号的衰减结果,通常测量部位为跟骨。QUS测量结果不仅与骨密度有不同程度的相关,还可提供有关骨应力、结构等方面的信息。目前主要用于骨质疏松风险人群的筛查和骨质疏松性骨折的风险评估,但还不能用于骨质疏松症的诊断和药物疗效判断。目前国内外尚无统一的QUS筛查判定标准,可参考QUS设备厂家提供的信息,如结果怀疑骨质疏松,应进一步行DXA测量。
二
胸腰椎X线侧位影像及其骨折判定
椎体骨折常因无明显临床症状被漏诊,需要在骨质疏松性骨折的危险人群中开展椎体骨折的筛查。胸腰椎X线侧位影像可作为判定骨质疏松性椎体压缩性骨折首选的检查方法。常规胸腰椎X线侧位摄片的范围应分别包括胸4至腰1和胸12至腰5椎体。基于胸腰椎侧位X线影像并采用Genant目视半定量判定方法(图3),椎体压缩性骨折的程度可以分为Ⅰ、Ⅱ、Ⅲ度或称轻、中、重度。该判定方法分度是依据压缩椎体最明显处的上下高度与同一椎体后高之比;若全椎体压缩,则压缩最明显处的上下高度与其邻近上一椎体后高之比;椎体压缩性骨折的轻、中、重度判定标准分别为椎体压缩20%~25%、25%~40%及40%以上。
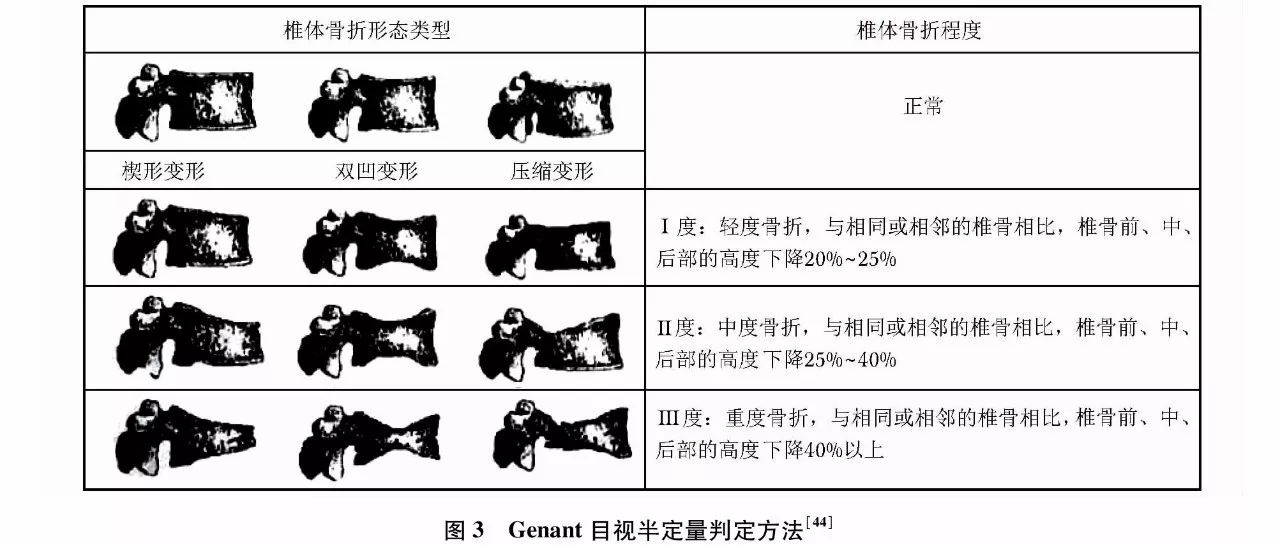
另外,DXA胸腰椎的侧位椎体成像和脊椎CT侧位重建影像的椎体压缩骨折的判定也可参照上述标准。如在胸腰椎X线侧位影像评估椎体压缩性骨折时见到其他异常X线征象时,应进一步选择适宜的影像学检查,进行影像诊断和鉴别诊断。
建议存在以下情况时,行胸腰椎侧位X线影像或DXA侧位椎体骨折评估(VFA),以了解是否存在椎体骨折(表6)。

三
骨转换标志物
骨转换标志物(bone turnover markers, BTMs), 是骨组织本身的代谢(分解与合成)产物,简称骨标志物。骨转换标志物分为骨形成标志物和骨吸收标志物(表7),前者反映成骨细胞活性及骨形成状态,后者代表破骨细胞活性及骨吸收水平。在正常人不同年龄段,以及不同疾病状态时,血循环或尿液中的骨转换标志物水平会发生不同程度的变化,代表了全身骨骼代谢的动态状况。这些标志物的测定有助于鉴别原发性和继发性骨质疏松、判断骨转换类型、预测骨丢失速率、评估骨折风险、了解病情进展、选择干预措施,监测药物疗效及依从性等。原发性骨质疏松症患者的骨转换标志物水平往往正常或轻度升高。如果骨转换生化标志物水平明显升高,需排除高转换型继发性骨质疏松症或其他疾病的可能性,如原发性甲状旁腺功能亢进症、畸形性骨炎及某些恶性肿瘤骨转移等。
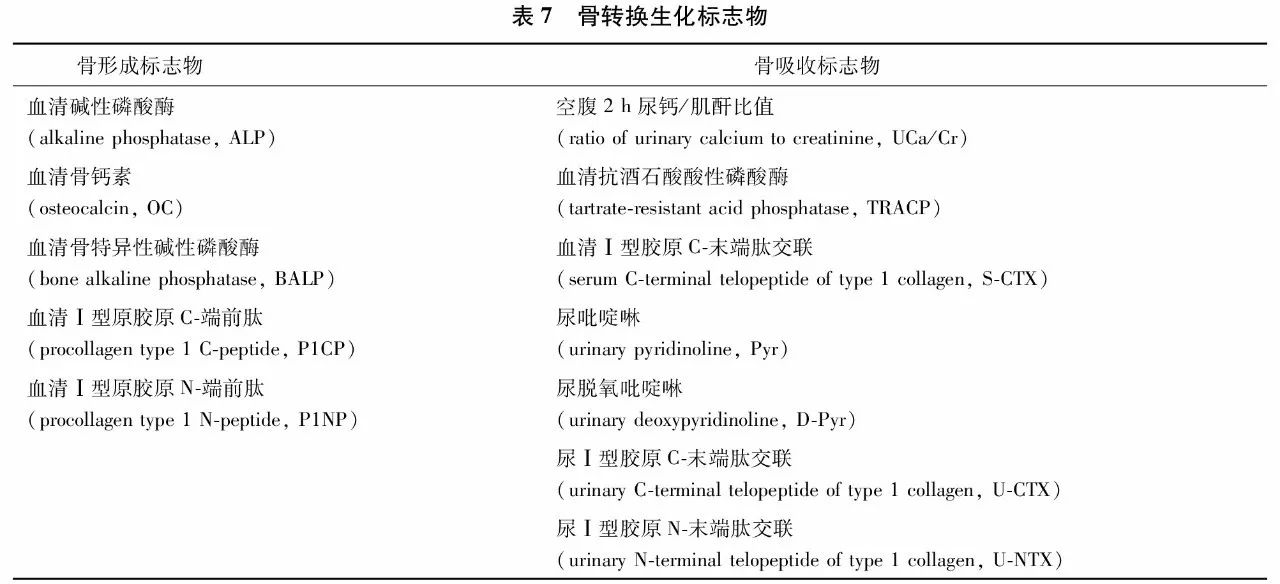
在以上诸多标志物中,推荐空腹血清Ⅰ型原胶原N-端前肽(procollagen type 1 N-peptide, P1NP)和空腹血清Ⅰ型胶原C-末端肽交联(serum C-terminal telopeptide of type 1 collagen, S-CTX)分别为反映骨形成和骨吸收敏感性较高的标志物。
四
骨质疏松诊断
骨质疏松症的诊断主要基于DXA骨密度测量结果和/或脆性骨折。
1. 基于骨密度测定的诊断
DXA测量的骨密度是目前通用的骨质疏松症诊断指标。对于绝经后女性、50岁及以上男性,建议参照WHO推荐的诊断标准,基于DXA测量结果(表8):骨密度值低于同性别、同种族健康成人的骨峰值1个标准差及以内属正常;降低1~2.5个标准差为骨量低下(或低骨量);降低等于和超过2.5个标准差为骨质疏松;骨密度降低程度符合骨质疏松诊断标准,同时伴有一处或多处脆性骨折为严重骨质疏松。骨密度通常用T-值(T-Score)表示,T-值= (实测值-同种族同性别正常青年人峰值骨密度)/同种族同性别正常青年人峰值骨密度的标准差。基于DXA测量的中轴骨(腰椎1-4、股骨颈或全髋)骨密度或桡骨远端1/3骨密度对骨质疏松症的诊断标准是T-值≤-2.5。

对于儿童、绝经前女性和50岁以下男性,其骨密度水平的判断建议用同种族的Z值表示,Z-值=(骨密度测定值-同种族同性别同龄人骨密度均值)/同种族同性别同龄人骨密度标准差。将Z-值≤-2.0视为“低于同年龄段预期范围”或低骨量。
2. 基于脆性骨折的诊断
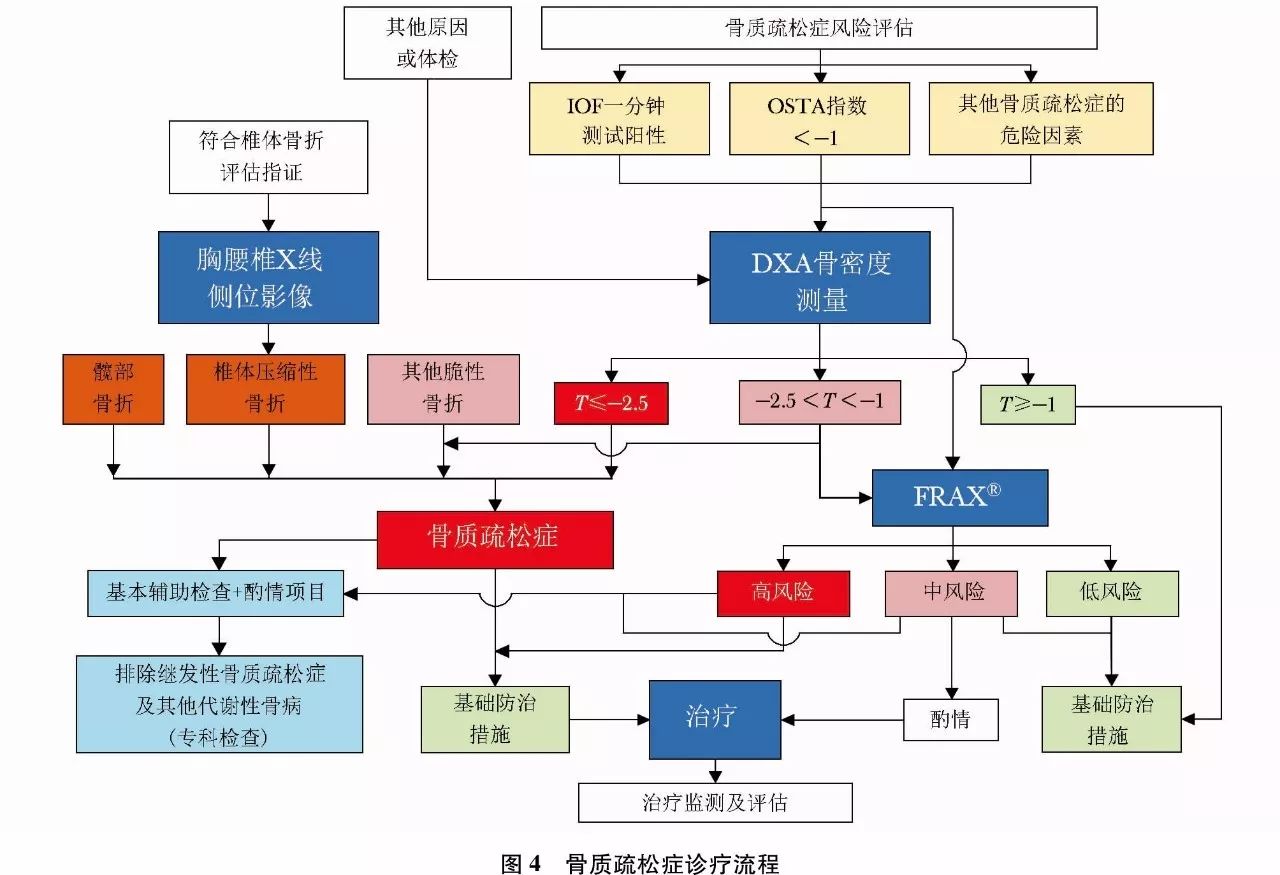
脆性骨折是指受到轻微创伤或日常活动中即发生的骨折。如髋部或椎体发生脆性骨折,不依赖于骨密度测定,临床上即可诊断骨质疏松症。而在肱骨近端、骨盆或前臂远端发生的脆性骨折,即使骨密度测定显示低骨量(-2.5<T-值<-1.0),也可诊断骨质疏松症。骨质疏松症的诊断标准见表9。骨质疏松症诊疗流程见(图4)。

五
骨质疏松症鉴别诊断及实验室检查
1. 骨质疏松症鉴别诊断
骨质疏松可由多种病因所致。在诊断原发性骨质疏松症之前,一定要重视和排除其他影响骨代谢的疾病,以免发生漏诊或误诊。需详细了解病史,评价可能导致骨质疏松症的各种病因、危险因素及药物,特别强调部分导致继发性骨质疏松症的疾病可能缺少特异的症状和体征,有赖于进一步辅助检查。需要鉴别的病因参见(表1),主要包括:影响骨代谢的内分泌疾病(甲状旁腺疾病、性腺疾病、肾上腺疾病和甲状腺疾病等),类风湿关节炎等免疫性疾病,影响钙和维生素D吸收和代谢的消化系统和肾脏疾病,神经肌肉疾病,多发性骨髓瘤等恶性疾病,多种先天和获得性骨代谢异常疾病,长期服用糖皮质激素或其他影响骨代谢药物等。
2. 基本检查项目
对已诊断和临床怀疑骨质疏松症的患者至少应做以下几项基本检查,以助诊断和鉴别诊断。
(1) 基本实验室检查:血常规,尿常规,肝、肾功能,血钙、磷和碱性磷酸酶水平,血清蛋白电泳,尿钙、钠、肌酐和骨转换标志物等。
原发性骨质疏松症患者通常血钙、磷和碱性磷酸酶值在正常范围,当有骨折时血碱性磷酸酶水平可有轻度升高。如以上检查发现异常,需要进一步检查,或转至相关专科做进一步鉴别诊断。
(2) 骨骼X线影像:虽可根据常规X线影像骨结构稀疏评估骨质疏松,但X线影像显示骨质疏松时其骨质已丢失达30%以上。胸腰椎侧位X线影像可作为骨质疏松椎体压缩性骨折及其程度判定的首选方法。另外,X像影像所示的骨质密度受投照条件和阅片者主观等因素的影响,且不易量化评估,故X线影像不用于骨质疏松症的早期诊断。但根据临床症状和体征选择性进行相关部位的骨骼X线影像检查,可反映骨骼的病理变化,为骨质疏松症的诊断和鉴别诊断提供依据。
3. 酌情检查项目
为进一步鉴别诊断的需要,可酌情选择性进行以下检查,如血沉、C-反应蛋白、性腺激素、血清泌乳素、25羟维生素D(25-hydroxy-vitamin D, 25OHD)、甲状旁腺激素、甲状腺功能、尿游离皮质醇或小剂量地塞米松抑制试验、血气分析、尿本周蛋白、血尿轻链,甚至放射性核素骨扫描、骨髓穿刺或骨活检等检查。
骨折疏松症防治
骨骼强壮是维持人体健康的关键,骨质疏松症的防治应贯穿于生命全过程,骨质疏松性骨折会增加致残率或致死率,因此骨质疏松症的预防与治疗同等重要。骨质疏松症的主要防治目标包括改善骨骼生长发育,促进成年期达到理想的峰值骨量;维持骨量和骨质量,预防增龄性骨丢失;避免跌倒和骨折。骨质疏松症初级预防:指尚无骨质疏松但具有骨质疏松症危险因素者,应防止或延缓其发展为骨质疏松症并避免发生第一次骨折;骨质疏松症二级预防和治疗:指已有骨质疏松症或已经发生过脆性骨折,防治目的是避免发生骨折或再次骨折。
骨质疏松症的防治措施主要包括基础措施、药物干预和康复治疗。
一
基础措施
包括调整生活方式和骨健康基本补充剂。
1. 调整生活方式
(1) 加强营养,均衡膳食:建议摄入富含钙、低盐和适量蛋白质的均衡膳食,推荐每日蛋白质摄入量为0.8~1.0 g/kg体质量,并每天摄入牛奶300 ml或相当量的奶制品。
(2) 充足日照:建议上午11:00到下午3:00间,尽可能多地暴露皮肤于阳光下晒15~30 min(取决于日照时间、纬度、季节等因素),每周两次,以促进体内维生素D的合成,尽量不涂抹防晒霜,以免影响日照效果。但需注意避免强烈阳光照射,以防灼伤皮肤。
(3) 规律运动:建议进行有助于骨健康的体育锻炼和康复治疗。运动可改善机体敏捷性、力量、姿势及平衡等,减少跌倒风险。运动还有助于增加骨密度。适合于骨质疏松症患者的运动包括负重运动及抗阻运动,推荐规律的负重及肌肉力量练习,以减少跌倒和骨折风险。肌肉力量练习包括重量训练,其他抗阻运动及行走、慢跑、太极拳、瑜伽、舞蹈和兵乓球等。运动应循序渐进、持之以恒。骨质疏松症患者开始新的运动训练前应咨询临床医生,进行相关评估。
(4) 戒烟。
(5) 限酒。
(6) 避免过量饮用咖啡。
(7) 避免过量饮用碳酸饮料。
(8) 尽量避免或少用影响骨代谢的药物。
2. 骨健康基本补充剂
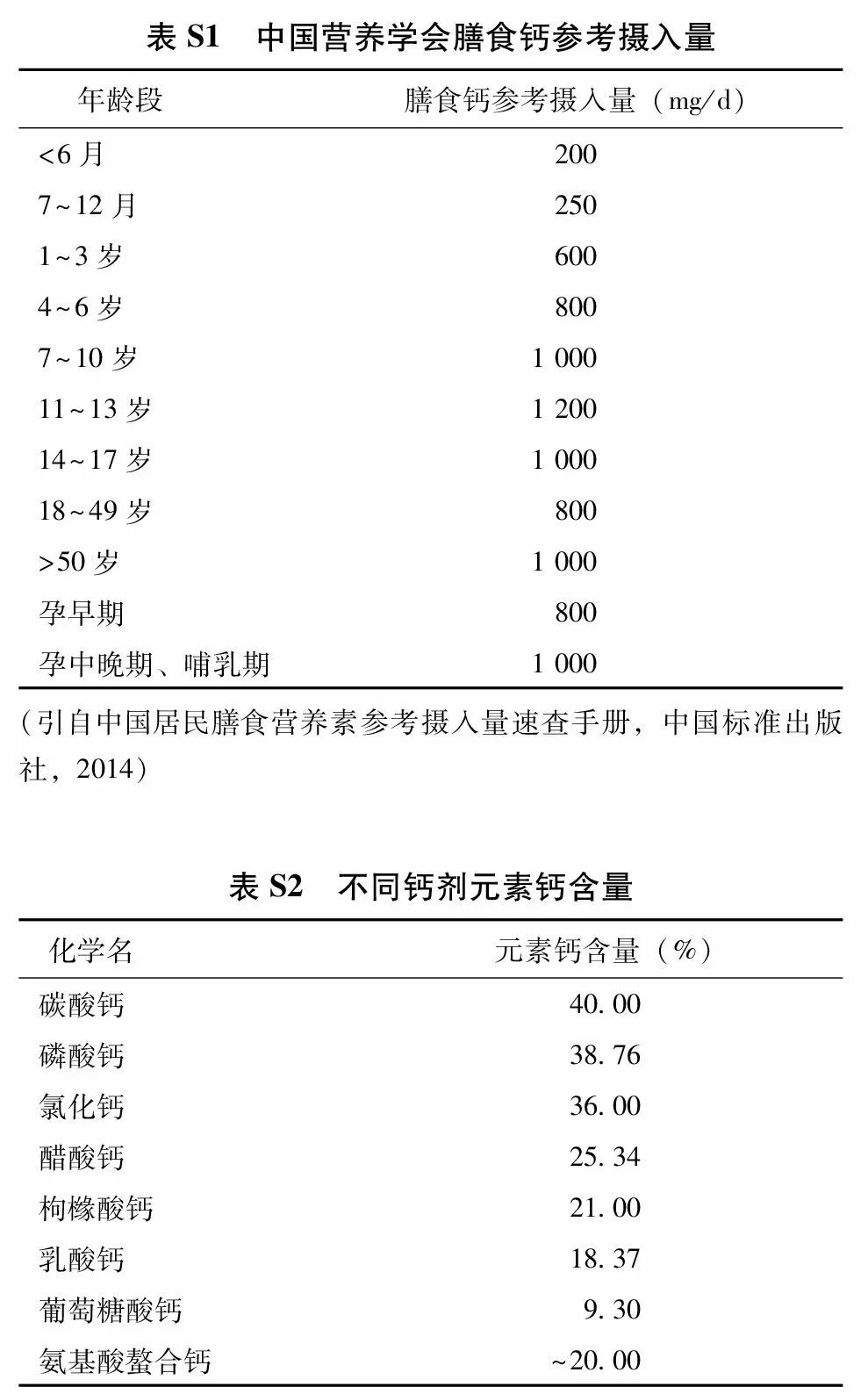
(1) 钙剂:充足的钙摄入对获得理想骨峰值、减缓骨丢失、改善骨矿化和维护骨骼健康有益。2013版中国居民膳食营养素参考摄入量(附件表S1) 建议,成人每日钙推荐摄入量为800 mg(元素钙),50岁及以上人群每日钙推荐摄入量为1 000~1 200 mg。尽可能通过饮食摄入充足的钙,饮食中钙摄入不足时,可给予钙剂补充。营养调查显示我国居民每日膳食约摄入元素钙400 mg,故尚需补充元素钙约500~600 mg/d。钙剂选择需考虑其钙元素含量、安全性和有效性。不同种类钙剂中的元素钙含量见附件表S2,其中碳酸钙含钙量高,吸收率高,易溶于胃酸,常见不良反应为上腹不适和便秘等。枸橼酸钙含钙量较低,但水溶性较好,胃肠道不良反应小,且枸橼酸有可能减少肾结石的发生,适用于胃酸缺乏和有肾结石风险的患者。高钙血症和高钙尿症时应避免使用钙剂。补充钙剂需适量,超大剂量补充钙剂可能增加肾结石和心血管疾病的风险。在骨质疏松症的防治中,钙剂应与其他药物联合使用,目前尚无充分证据表明单纯补钙可以替代其他抗骨质疏松药物治疗。
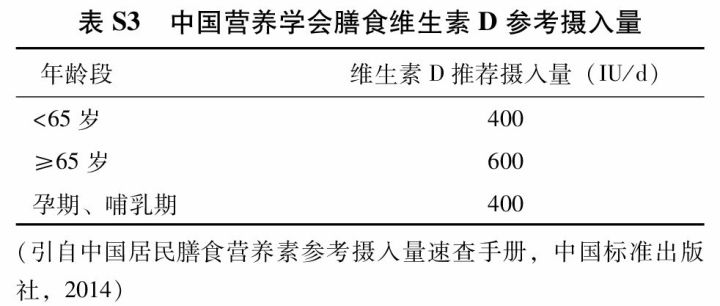
(2) 维生素D:充足的维生素D可增加肠钙吸收、促进骨骼矿化、保持肌力、改善平衡能力和降低跌倒风险。维生素D不足可导致继发性甲状旁腺功能亢进,增加骨吸收,从而引起或加重骨质疏松症。同时补充钙剂和维生素D可降低骨质疏松性骨折风险。维生素D不足还会影响其他抗骨质疏松药物的疗效。在我国维生素D不足状况普遍存在,7个省份的调查报告显示:55岁以上女性血清25OHD平均浓度为18 μg/L,61.0%绝经后女性存在维生素D缺乏。2013版中国居民膳食营养素参考摄入量(附件表S3) 建议,成人推荐维生素D摄入量为400 IU(10 μg)/d;65岁及以上老年人因缺乏日照、以及摄入和吸收障碍常有维生素D缺乏,推荐摄入量为600 IU(15 μg)/d;可耐受最高摄入量为2 000 IU(50 μg)/d;维生素D用于骨质疏松症防治时,剂量可为800~1 200 IU/d。对于日光暴露不足和老年人等维生素D缺乏的高危人群,建议酌情检测血清25OHD水平,以了解患者维生素D的营养状态,指导维生素D的补充。有研究建议老年人血清25OHD水平应达到或高于75 nmol/L(30 μg/L),以降低跌倒和骨折风险。临床应用维生素D制剂时应注意个体差异和安全性,定期监测血钙和尿钙浓度。不推荐使用活性维生素D纠正维生素D缺乏,不建议1年单次较大剂量普通维生素D的补充。
二
抗骨质疏松症药物
有效的抗骨质疏松症药物可以增加骨密度,改善骨质量,显著降低骨折的发生风险,本指南推荐抗骨质疏松症药物治疗的适应证(表10):主要包括经骨密度检查确诊为骨质疏松症的患者;已经发生过椎体和髋部等部位脆性骨折者;骨量减少但具有高骨折风险的患者。

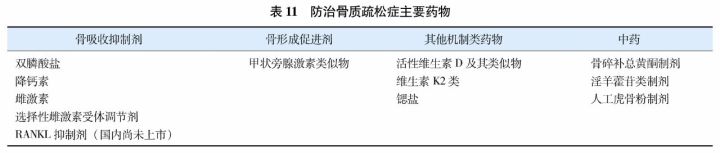
抗骨质疏松症药物按作用机制可分为骨吸收抑制剂、骨形成促进剂、其他机制类药物及传统中药(表11)。通常首选使用具有较广抗骨折谱的药物(如阿仑膦酸钠、唑来膦酸、利塞膦酸钠和迪诺塞麦等)。对低、中度骨折风险者(如年轻的绝经后妇女,骨密度水平较低但无骨折史)首选口服药物治疗。对口服不能耐受、禁忌、依从性欠佳及高骨折风险者(如多发椎体骨折或髋部骨折的老年患者、骨密度极低的患者)可考虑使用注射制剂(如唑来膦酸、特立帕肽或迪诺塞麦等)。如仅椎体骨折高风险,而髋部和非椎体骨折风险不高的患者,可考虑选用雌激素或选择性雌激素受体调节剂(selected estrogen receptor modulators, SERMs)。新发骨折伴疼痛的患者可考虑短期使用降钙素。迪诺塞麦(denosumab)是RANKL的抑制剂,为单克隆抗体,国外已经广泛使用,在国内已经完成三期临床试验,尽管尚未(即将)上市,亦纳入本指南。中药具有改善临床症候等作用,但降低骨质疏松性骨折的证据尚不足。现就国家食品药品监督管理局(China Food and Drug Administration, CFDA)已经批准的主要抗骨骨质疏松症药物的特征和应用规范介绍如下(药物类别按照英文字母排序)。
1. 双膦酸盐类
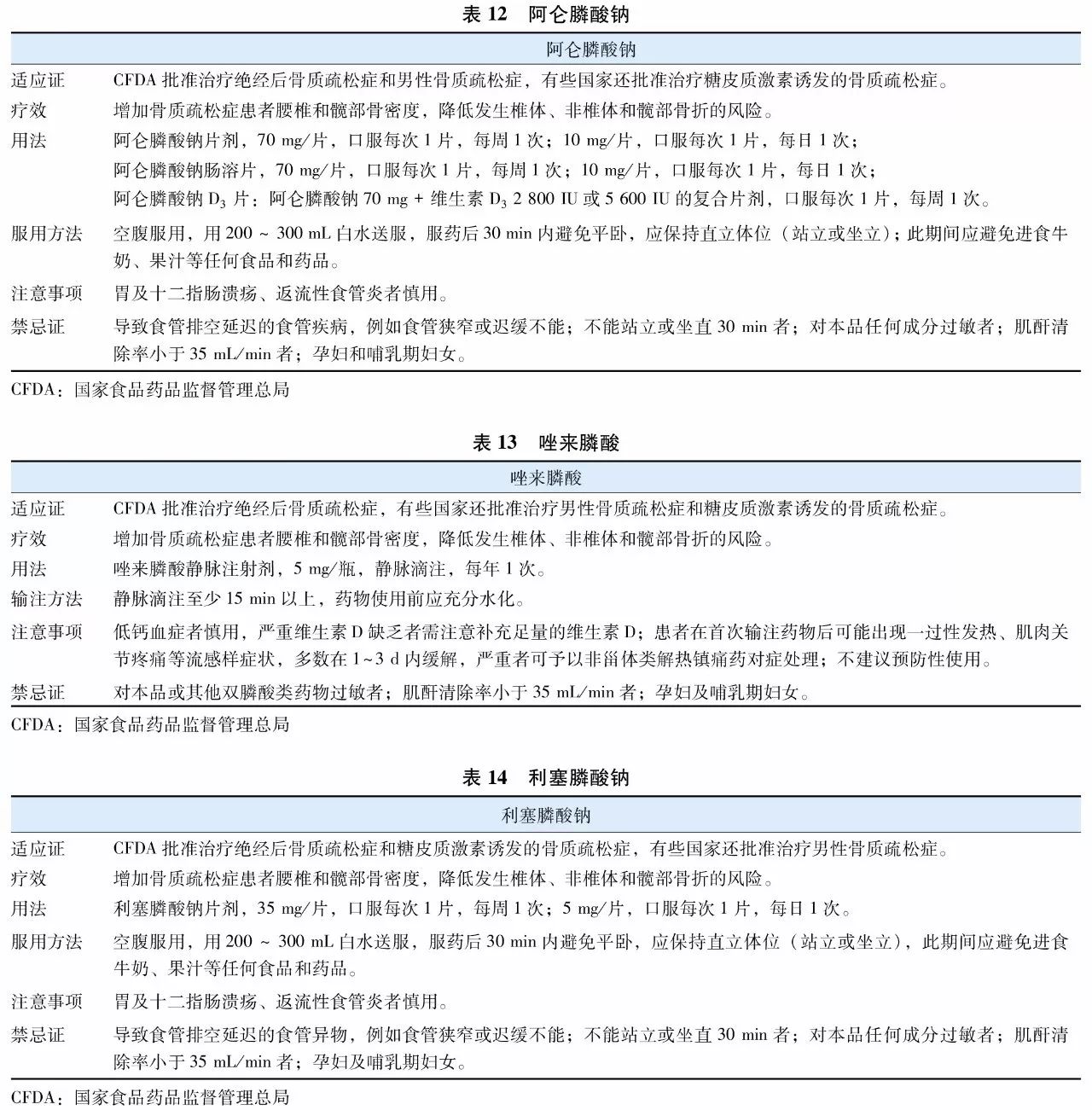
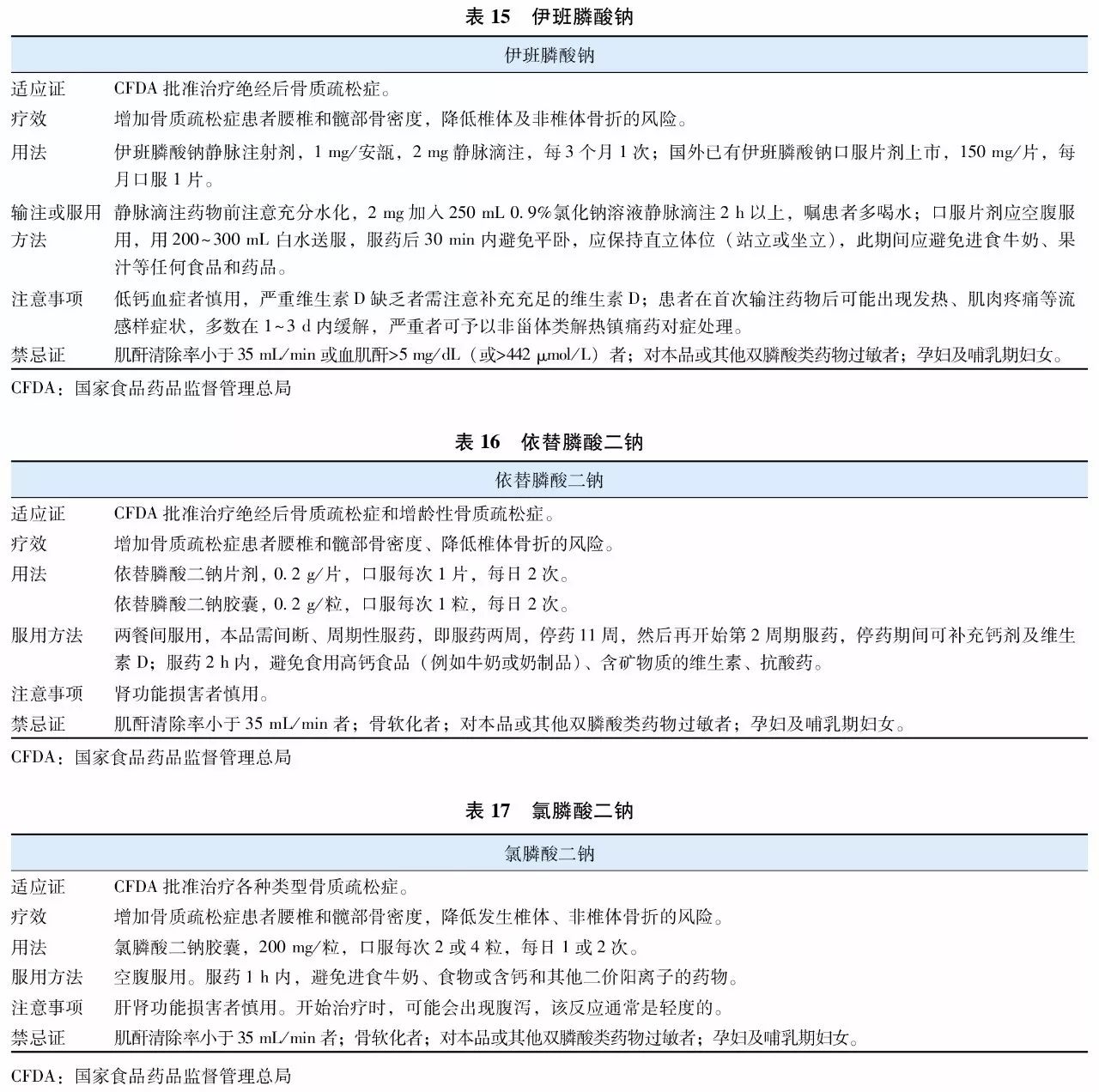
双膦酸盐(bisphosphonates)是焦磷酸盐的稳定类似物,其特征为含有P-C-P基团。是目前临床上应用最为广泛的抗骨质疏松症药物。双膦酸盐与骨骼羟磷灰石的亲和力高,能够特异性结合到骨重建活跃的骨表面,抑制破骨细胞功能,从而抑制骨吸收。不同双膦酸盐抑制骨吸收的效力差别很大,因此临床上不同双膦酸盐药物使用剂量及用法也有所差异。目前用于防治骨质疏松症的双膦酸盐主要包括阿仑膦酸钠(表12)、唑来膦酸(表13)、利塞膦酸钠(表14)、伊班膦酸钠(表15)、依替膦酸二钠(表16)和氯膦酸二钠(表17)等。
双膦酸盐类药物总体安全性较好,但以下几点值得关注:
(1) 胃肠道不良反应:口服双膦酸盐后少数患者可能发生轻度胃肠道反应,包括上腹疼痛、反酸等症状。故除严格按说明书提示的方法服用外,有活动性胃及十二指肠溃疡、返流性食管炎者、功能性食管活动障碍者慎用。若存在肠吸收不良,可能影响双膦酸盐的吸收。
(2) 一过性“流感样”症状:首次口服或静脉输注含氮双膦酸盐可出现一过性发热、骨痛和肌痛等类流感样不良反应,多在用药3 d内明显缓解,症状明显者可用非甾体抗炎药或其他解热镇痛药对症治疗。
(3) 肾脏毒性:进入血液的双膦酸盐类药物约60%以原形从肾脏排泄,对于肾功能异常的患者,应慎用此类药物或酌情减少药物剂量。特别是静脉输注的双膦酸盐类药物,每次给药前应检测肾功能,肌酐清除率<35 mL/min患者禁用。尽可能使患者水化,静脉输注唑来膦酸的时间应不少于15 min,伊班膦酸钠静脉输注时间不少于2 h。
(4) 下颌骨坏死(osteonecrosis of the jaw, ONJ):双膦酸盐相关的ONJ罕见。绝大多数(超过90%)发生于恶性肿瘤患者应用大剂量注射双膦酸盐以后,以及存在严重口腔疾病的患者,如严重牙周病或多次牙科手术等。ONJ主要见于使用静脉注射双膦酸盐的肿瘤患者,发生率不等,约1%~15%。而在骨质疏松症患者中,ONJ发病率仅为0.001%~0.01%,略高于正常人群(<0.001%)。对患有严重口腔疾病或需要接受牙科手术的患者,不建议使用该类药物。降低ONJ发生风险的措施:在开始抗骨吸收治疗前完成必要的口腔手术,在口腔手术前后使用抗生素,采用抗菌漱口液,拔牙后正确闭合创面,保持良好的口腔卫生。对存在ONJ高风险患者(伴有糖尿病、牙周病、使用糖皮质激素、免疫缺陷、吸烟等)需要复杂侵入性口腔手术时,建议暂停双膦酸盐治疗3~6个月后,再实施口腔手术,术后3个月如无口腔特殊情况,可恢复使用双膦酸盐。
(5) 非典型股骨骨折(atypical femur fracture, AFF):即在低暴力下发生在股骨小转子以下到股骨髁上之间的骨折,AFF可能与长期应用双膦酸盐类药物有关。对于长期使用双膦酸盐患者(3年以上),一旦出现大腿或者腹股沟部位疼痛,应进行双股骨X线摄片检查,明确是否存在AFF,MRI或核素骨扫描均有助于AFF的确诊。长期使用双膦酸盐的患者中(通常3年以上,中位治疗时间7年),AFF风险轻微增加,停用双膦酸盐以后,风险随之下降。AFF在使用双膦酸盐患者中绝对风险非常低(3.2~50例/10万人年),一旦发生AFF,应立即停止使用双膦酸盐等抗骨吸收药物。
2. 降钙素类
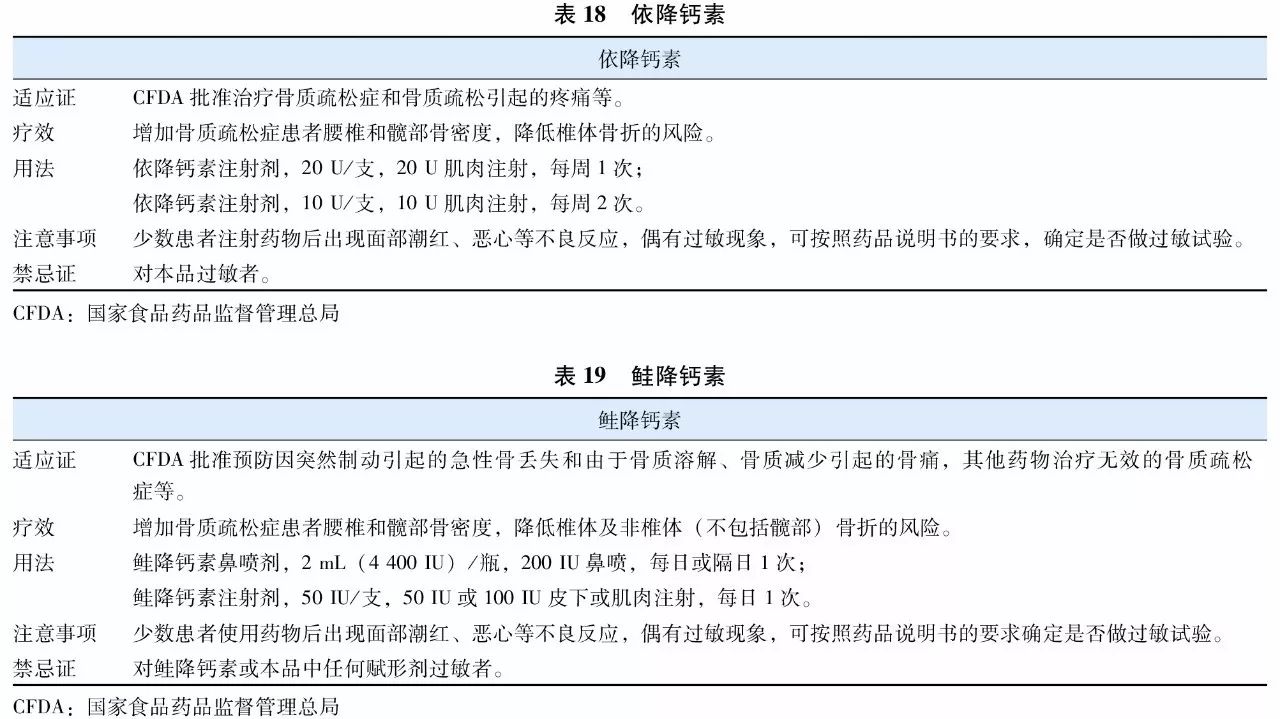
降钙素(calcitonin)是一种钙调节激素,能抑制破骨细胞的生物活性、减少破骨细胞数量,减少骨量丢失并增加骨量。降钙素类药物的另一突出特点是能明显缓解骨痛,对骨质疏松症及其骨折引起的骨痛有效。目前应用于临床的降钙素类制剂有两种:鳗鱼降钙素类似物(表18)和鲑降钙素(表19)。
降钙素总体安全性良好,少数患者使用后出现面部潮红、恶心等不良反应,偶有过敏现象,可按照药品说明书的要求,确定是否做过敏试验。降钙素类制剂应用疗程要视病情及患者的其他条件而定。
2012年欧洲药品管理局人用药机构委员会通过Meta分析发现,长期使用(6个月或更长时间)鲑降钙素口服或鼻喷剂型与恶性肿瘤风险轻微增加相关,但无法肯定该药物与恶性肿瘤之间的确切关系;鉴于鼻喷剂型鲑降钙素具有潜在增加肿瘤风险的可能,鲑降钙素连续使用时间一般不超过3个月。
3. 绝经激素治疗
绝经激素治疗(menopausal hormone therapy, MHT)类药物(表20)能抑制骨转换,减少骨丢失。临床研究已证明MHT包括雌激素补充疗法(estrogen therapy, ET)和雌、孕激素补充疗法(estrogen plus progestogen therapy, EPT),能减少骨丢失,降低骨质疏松性椎体、非椎体及髋部骨折的风险,是防治绝经后骨质疏松症的有效措施。

绝经妇女正确使用绝经激素治疗,总体是安全的,以下几点为人们特别关注的问题。
(1) 子宫内膜癌:对有子宫的妇女长期只补充雌激素,证实可能增加子宫内膜癌的风险。自20世纪70年代以来,研究表明对有子宫妇女补充雌激素的同时适当补充孕激素,子宫内膜癌的风险不再增加。所以,有子宫的妇女应用雌激素治疗时必须联合应用孕激素。
(2) 乳腺癌:国际绝经学会最新推荐:乳腺癌的相关因素很多,与绝经激素治疗相关的乳腺癌风险很低,小于每年1/1 000,且应用5年内没有发现乳腺癌风险增加。美国妇女健康倡议(Women's Health Initiative, WHI)研究中,单用雌激素超过7年,乳腺癌风险也没有增加,但雌激素加孕激素组5年后乳腺癌风险有所增加。关于绝经激素治疗的全球共识指出,激素治疗与乳腺癌的关系主要取决于孕激素及其应用时间长短。与合成的孕激素相比,微粒化黄体酮和地屈孕酮与雌二醇联用,乳腺癌的风险更低。乳腺癌是绝经激素治疗的禁忌症。
(3) 心血管病疾病:绝经激素治疗不用于心血管疾病的预防。无心血管病危险因素的女性,60岁以前或绝经不到10年开始激素治疗,可能对其心血管有一定的保护作用;已有心血管损害,或60岁后再开始激素治疗,则没有此保护作用。
(4) 血栓:绝经激素治疗轻度增加血栓风险。血栓是激素治疗的禁忌证。非口服雌激素因没有肝脏首过效应,其血栓风险更低。
(5) 体质量增加:雌激素为非同化激素,常规剂量没有增加体质量的作用。只有当大剂量使用时才会引起水钠潴留、体质量增加。绝经后激素治疗使用的低剂量一般不会引起水钠潴留。雌激素对血脂代谢和脂肪分布都有一定的有利影响。
鉴于对上述问题的考虑,建议激素补充治疗遵循以下原则:① 明确治疗的利与弊; ② 绝经早期开始用(<60岁或绝经10年之内),收益更大,风险更小; ③ 应用最低有效剂量; ④ 治疗方案个体化; ⑤ 局部问题局部治疗; ⑥ 坚持定期随访和安全性监测(尤其是乳腺和子宫)。⑦ 是否继续用药,应根据每位妇女的特点,每年进行利弊评估。
4. 选择性雌激素受体调节剂类
选择性雌激素受体调节剂类(selective estro-gen receptor modulators, SERMs),SERMs不是雌激素,而是与雌激素受体结合后,在不同靶组织导致受体空间构象发生不同改变,从而在不同组织发挥类似或拮抗雌激素的不同生物效应。如SERMs制剂雷洛昔芬(表21)在骨骼与雌激素受体结合,发挥类雌激素的作用,抑制骨吸收,增加骨密度,降低椎体骨折发生的风险;而在乳腺和子宫则发挥拮抗雌激素的作用,因而不刺激乳腺和子宫,有研究表明其能够降低雌激素受体阳性浸润性乳癌的发生率。

雷洛昔芬药物总体安全性良好。国外研究报告该药轻度增加静脉栓塞的危险性,国内尚未见类似报道。故有静脉栓塞病史及有血栓倾向者,如长期卧床和久坐者禁用。对心血管疾病高风险的绝经后女性的研究显示,雷洛昔芬并不增加冠状动脉疾病和卒中风险。雷洛昔芬不适用于男性骨质疏松症患者。
5. 甲状旁腺素类似物
甲状旁腺素类似物(parathyroid hormone analogue,PTHa)是当前促骨形成的代表性药物,国内已上市的特立帕肽(表22)是重组人甲状旁腺素氨基端1-34活性片段(recombinant human parathyroid hormone 1-34,rhPTH1-34)。间断使用小剂量PTHa能刺激成骨细胞活性,促进骨形成,增加骨密度,改善骨质量,降低椎体和非椎体骨折的发生风险。

患者对rhPTH1-34的总体耐受性良好。临床常见的不良反应为恶心、肢体疼痛、头痛和眩晕。在动物实验中,大剂量、长时间使用特立帕肽增加大鼠骨肉瘤的发生率。但该药在美国上市后7年骨肉瘤监测研究中,未发现特立帕肽和人骨肉瘤存在因果关系。特立帕肽治疗时间不宜超过24个月,停药后应序贯使用抗骨吸收药物治疗,以维持或增加骨密度,持续降低骨折风险。
6. 锶盐
锶(strontium)是人体必需的微量元素之一,参与人体多种生理功能和生化效应。锶的化学结构与钙和镁相似,在正常人体软组织、血液、骨骼和牙齿中存在少量的锶。雷奈酸锶(表23)是合成锶盐,体外实验和临床研究均证实雷奈酸锶可同时作用于成骨细胞和破骨细胞,具有抑制骨吸收和促进骨形成的双重作用,可降低椎体和非椎体骨折的发生风险。

雷奈酸锶药物总体安全性良好。常见的不良反应包括恶心、腹泻、头痛、皮炎和湿疹,一般在治疗初始时发生,程度较轻,多为暂时性,可耐受。罕见的不良反应为药物疹伴嗜酸性粒细胞增多和系统症状(drug rash with eosinophilia and systemic symptoms, DRESS) 。具有高静脉血栓风险的患者,包括既往有静脉血栓病史的患者,以及有药物过敏史者,应慎用雷奈酸锶。同时,需要关注该药物可能引起心脑血管严重不良反应,2014年欧洲药品管理局发布了对雷奈酸锶的评估公告:在保持雷奈酸锶上市许可的情况下限制该药物的使用,雷奈酸锶仅用于无法使用其他获批药物以治疗严重骨质疏松症患者。用药期间应对这些患者进行定期评估,如果患者出现了心脏或循环系统问题,例如发生了缺血性心脏病、外周血管病或脑血管疾病,或高血压未得到控制,应停用雷奈酸锶。存在某些心脏或循环系统问题,例如卒中和心脏病发作史的患者不得使用本药物。
7. 活性维生素D及其类似物
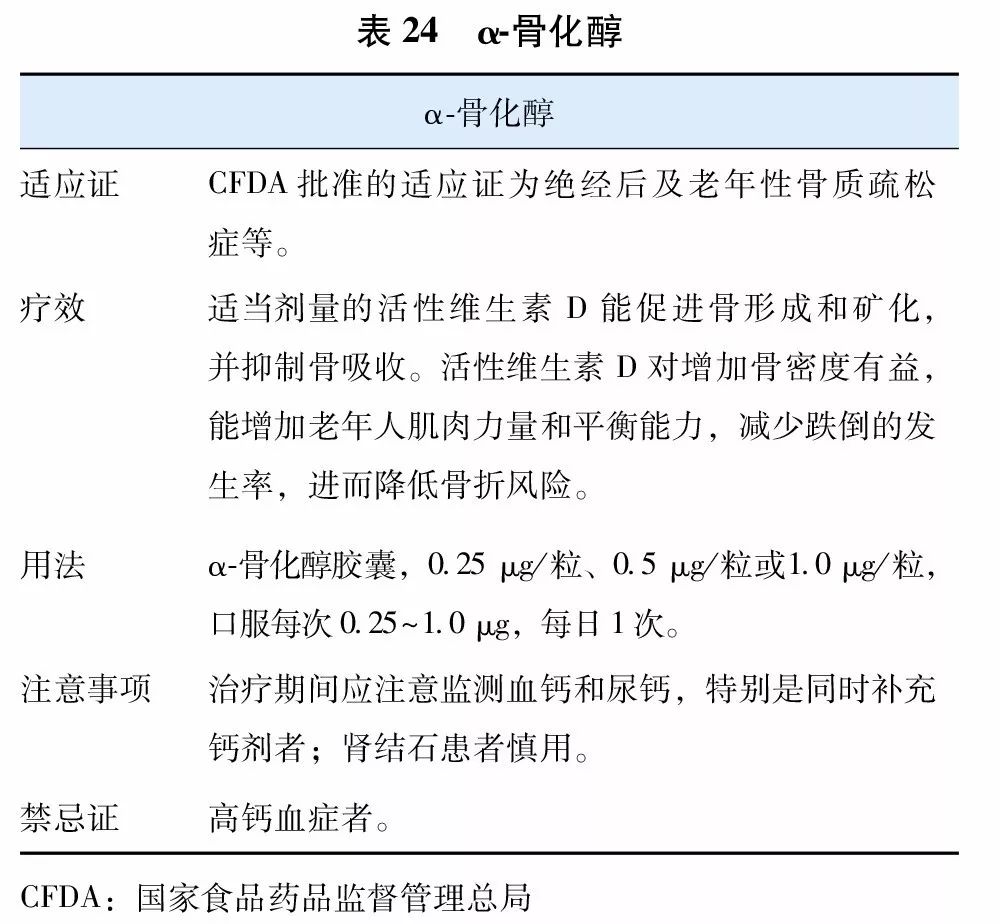
目前国内上市用于治疗骨质疏松症的活性维生素D及其类似物(vitamin D analogue)有1α羟维生素D3(α-骨化醇)(表24)和1, 25双羟维生素D3(骨化三醇)(表25)两种,国外上市的尚有艾迪骨化醇。因不需要肾脏1α羟化酶羟化就有活性,故得名为活性维生素D及其类似物。活性维生素D及其类似物更适用于老年人、肾功能减退以及1α羟化酶缺乏或减少的患者,具有提高骨密度,减少跌倒,降低骨折风险的作用。
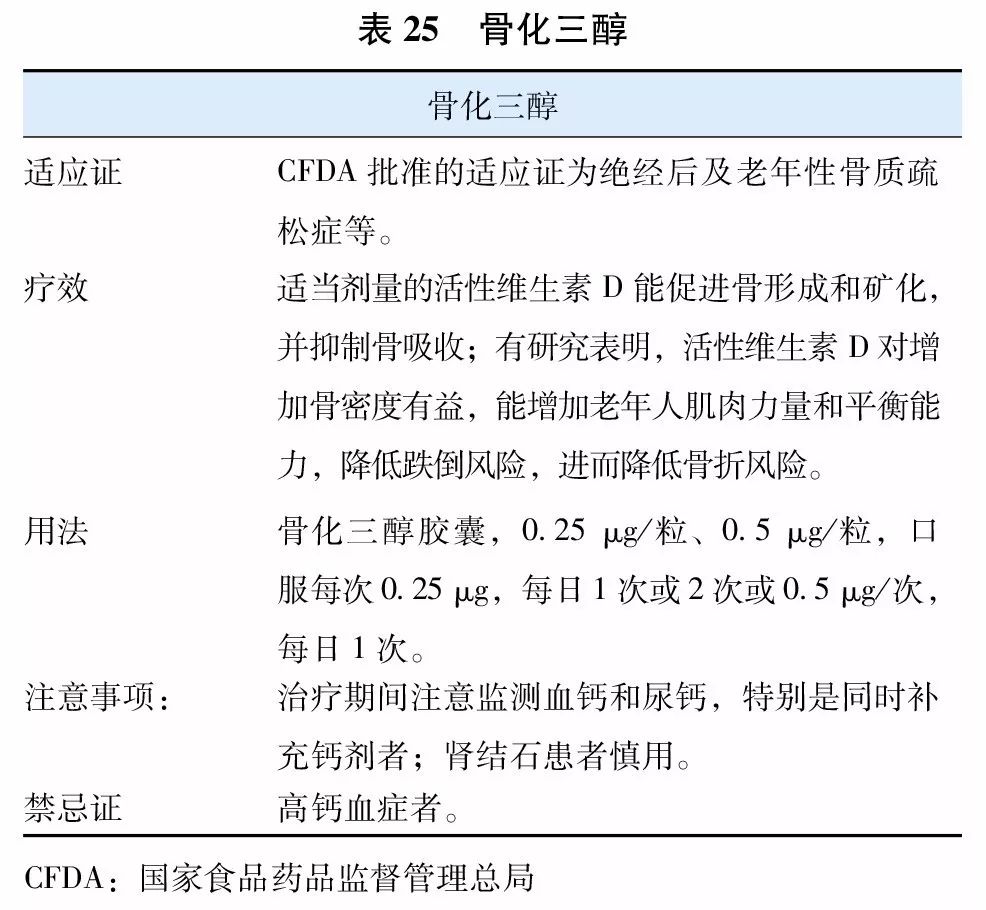
治疗骨质疏松症时,应用上述剂量的活性维生素D总体是安全的。长期使用时,应在医师指导下使用,不宜同时补充较大剂量的钙剂,并建议定期监测患者血钙和尿钙水平。在治疗骨质疏松症时,可与其他抗骨质疏松药物联合应用。
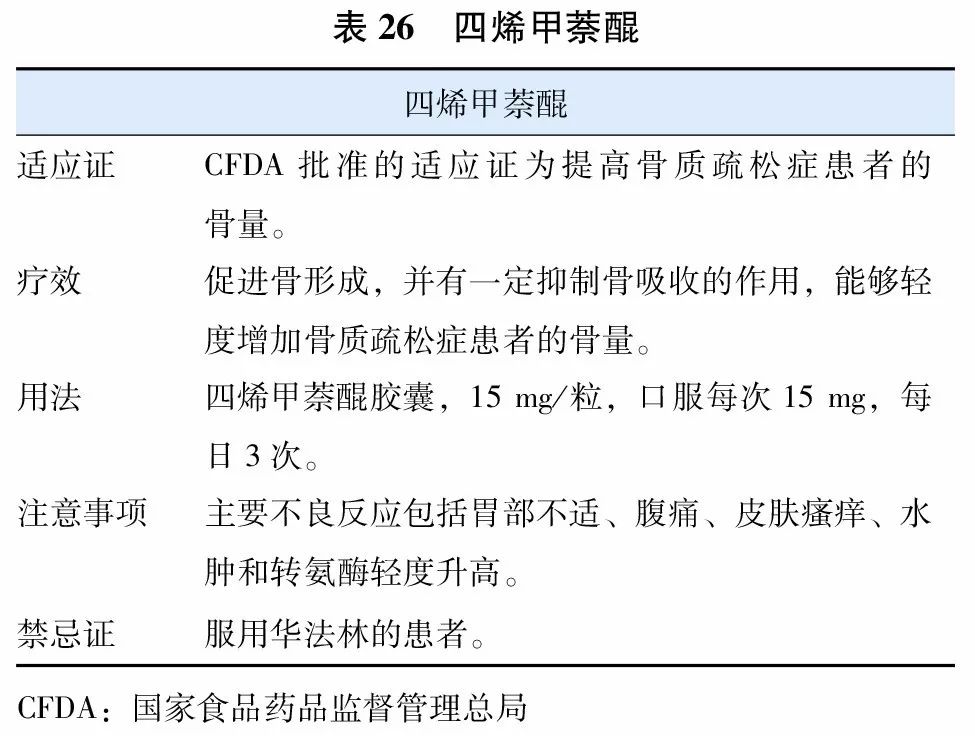
8. 维生素K类(四烯甲萘醌)
四烯甲萘醌(menatetrenone)(表26)是维生素K2的一种同型物,是γ-羧化酶的辅酶,在γ-羧基谷氨酸的形成过程中起着重要作用。γ-羧基谷氨酸是骨钙素发挥正常生理功能所必需的,具有提高骨量的作用。
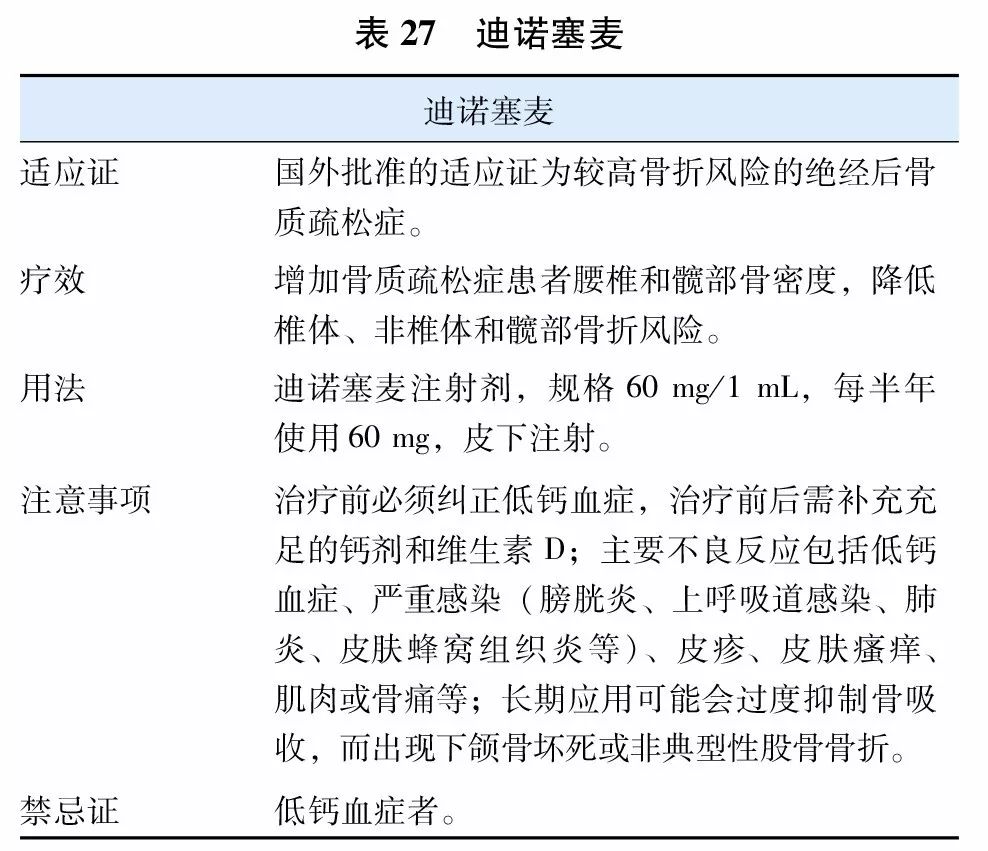
9. RANKL抑制剂
迪诺塞麦(denosumab)(表27)是一种核因子kappa-B受体活化因子配体(RANKL)抑制剂,为特异性RANKL的完全人源化单克隆抗体,能够抑制RANKL与其受体RANK的结合,减少破骨细胞形成、功能和存活,从而降低骨吸收、增加骨量、改善皮质骨或松质骨的强度。现已被美国FDA批准治疗有较高骨折风险的绝经后骨质疏松症。
三
使用抗骨质疏松药物临床关注问题
1. 关于疗程的建议
抗骨质疏松药物治疗的成功标志是骨密度保持稳定或增加,而且没有新发骨折或骨折进展的证据。对于正在使用抑制骨吸收药物的患者,治疗成功的目标是骨转换指标值维持在或低于绝经前妇女水平。患者在治疗期间如发生再次骨折或显著的骨量丢失,则需考虑换药或评估继发性骨质疏松的病因;如果治疗期间发生一次骨折,并不能表明药物治疗失败,但提示该患者骨折风险高。
除双膦酸盐药物外,其他抗骨质疏松药物一旦停止应用,疗效就会快速下降,双膦酸盐类药物停用后,其抗骨质疏松性骨折的作用可能会保持数年。另外,由于双膦酸盐类药物治疗超过5年的获益证据有限,而且使用超过5年,可能会增加罕见不良反应(如下颌骨坏死或非典型股骨骨折)的风险,建议双膦酸盐治疗3~5年后需考虑药物假期。目前建议口服双膦酸盐治疗5年,静脉双膦酸盐治疗3年,应对骨折风险进行评估,如为低风险,可考虑实施药物假期停用双膦酸盐;如骨折风险仍高,可以继续使用双膦酸盐或换用其他抗骨质疏松药物(如特立帕肽或雷洛昔芬)。特立帕肽疗程不应超过两年。
抗骨质疏松药物疗程应个体化,所有治疗应至少坚持1年,在最初3~5年治疗期后,应该全面评估患者发生骨质疏松性骨折的风险,包括骨折史、新出现的慢性疾病或用药情况、身高变化、骨密度变化、骨转换生化指标水平等。如患者治疗期间身高仍下降,则须进行胸腰椎X线摄片检查。
2. 关于骨折后应用抗骨质疏松药物
骨质疏松性骨折后应重视积极给予抗骨质疏松药物治疗,包括骨吸收抑制剂或骨形成促进剂等。迄今很多证据表明使用常规剂量的抗骨吸收药物,包括口服或静脉双膦酸类药物,对骨折愈合无明显不良影响。骨质疏松性骨折后,应建议开展骨折联络服务(fracture liaison service, FLS)管理项目,促进多学科联合诊治骨质疏松性骨折,及时合理使用治疗骨质疏松症的药物,以降低再发骨折的风险。
3. 抗骨质疏松药物联合和序贯治疗
骨质疏松症如同其他慢性疾病一样,不仅要长期、个体化治疗,也需药物联合或序贯治疗。甲状旁腺素类似物等骨形成促进剂获准使用后,药物的序贯或联合治疗更为普遍。目前已有的骨质疏松联合治疗方案,大多以骨密度变化为终点,其抗骨折疗效,尚有待进一步研究。总体来说,联合使用骨质疏松症治疗药物,应评价潜在的不良反应和治疗获益,此外,还应充分考虑药物经济学的影响。联合治疗方案包括同时联合方案及序贯联合方案。根据药物作用机制和特点,对联合用药暂做以下建议。
(1) 同时联合方案:钙剂及维生素D作为基础治疗药物,可以与骨吸收抑制剂或骨形成促进剂联合使用。
不建议联合应用相同作用机制的药物。个别情况为防止快速骨丢失,可考虑两种骨吸收抑制剂短期联合使用,如绝经后妇女短期使用小剂量雌/孕激素替代与雷洛昔芬,降钙素与双膦酸盐短期联合使用。
联合使用甲状旁腺素类似物等骨形成促进剂和骨吸收抑制剂,可增加骨密度,改善骨转换水平,但缺少对骨折疗效的证据,考虑到治疗的成本和获益,通常不推荐。仅用于骨吸收抑制剂治疗失败,或多次骨折需积极给予强有效治疗时。
(2) 序贯联合方案:尚无明确证据指出禁忌各种抗骨质疏松药物序贯应用。特别是如下情况要考虑药物序贯治疗:① 某些骨吸收抑制剂治疗失效、疗程过长或存在不良反应时;② 骨形成促进剂(PTH类似物)的推荐疗程仅为18~24个月,此类药物停药后应序贯治疗。推荐在使用甲状旁腺激素类似物等骨形成促进剂后序贯使用骨吸收抑制剂,以维持骨形成促进剂所取得的疗效。
四
中医中药治疗
中医学文献中无骨质疏松之名,按骨质疏松症主要临床表现,中医学中相近的病症有骨痿,见于没有明显的临床表现,或仅感觉腰背酸软无力的骨质疏松患者(“腰背不举,骨枯而髓减”);骨痹,症见“腰背疼痛,全身骨痛,身重、四肢沉重难举”的患者。根据中医药“肾主骨”,“脾主肌肉”及“气血不通则痛”的理论,治疗骨质疏松症以补肾益精、健脾益气、活血祛瘀为基本治法。中药治疗骨质疏松症多以改善症状为主,经临床证明有效的中成药可按病情选用。可能改善本病证侯的,且药物有效成分较明确的中成药主要包括骨碎补总黄酮(表28),淫羊藿苷(表29)和人工虎骨粉(表30)。
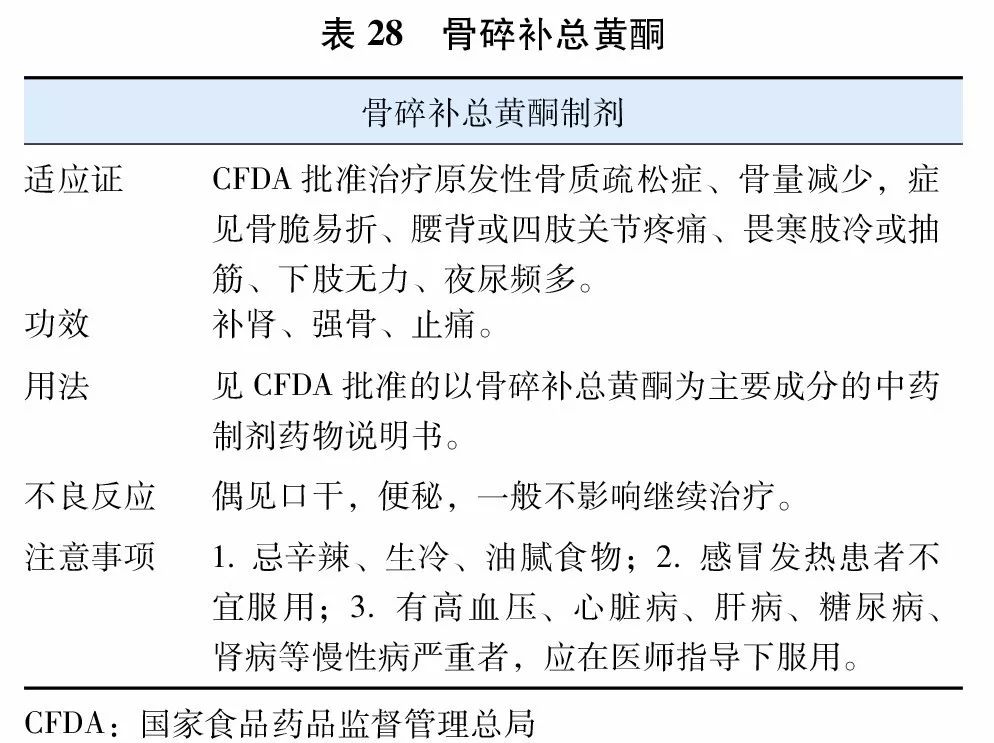

此外,中药古方青娥丸、六味地黄丸、左归丸、右归丸及CFDA批准具有改善骨质疏松症侯的中成药临床上均可根据中医辨证施治的原则运用。根据2015年12月CFDA发布的《中药新药治疗原发性骨质疏松症临床研究技术指导原则》,中药可以与钙剂和维生素D联用。
近年来,有关服用含有补骨质成分的中药制剂导致肝损伤的报告较多,故建议有肝病的骨质疏松症患者禁用该类制剂。
五
康复治疗
针对骨质疏松症的康复治疗主要包括运动疗法、物理因子治疗、作业疗法及康复工程等。
1. 运动疗法
运动疗法简单实用,不仅可增强肌力与肌耐力,改善平衡、协调性与步行能力,还可改善骨密度、维持骨结构,降低跌倒与脆性骨折风险等,发挥综合防治作用。运动疗法需遵循个体化、循序渐进、长期坚持的原则。治疗性运动包括有氧运动(如慢跑、游泳)、抗阻运动(如负重练习)、冲击性运动(如体操、跳绳)、振动运动(如全身振动训练)等[128]。我国传统健身方法太极拳等可增加髋部及腰椎骨密度,增强肌肉力量,改善韧带及肌肉、肌腱的柔韧性,提高本体感觉,加强平衡能力,降低跌倒风险。运动锻炼要注意少做躯干屈曲、旋转动作。骨质疏松性骨折早期应在保证骨折断端稳定性的前提下,加强骨折邻近关节被动运动(如关节屈伸等)及骨折周围肌肉的等长收缩训练等,以预防肺部感染、关节挛缩、肌肉萎缩及废用性骨质疏松;后期应以主动运动、渐进性抗阻运动及平衡协调与核心肌力训练为主。
2. 物理因子治疗
脉冲电磁场、体外冲击波、全身振动、紫外线等物理因子治疗可增加骨量;超短波、微波、经皮神经电刺激、中频脉冲等治疗可减轻疼痛;对骨质疏松骨折或者骨折延迟愈合可选择低强度脉冲超声波、体外冲击波等治疗以促进骨折愈合。神经肌肉电刺激、针灸等治疗可增强肌力、促进神经修复,改善肢体功能。联合治疗方式与治疗剂量需依据患者病情与自身耐受程度选择。
3. 作业疗法
作业疗法以针对骨质疏松症患者的康复宣教为主,包括指导患者正确的姿势,改变不良生活习惯,提高安全性。作业疗法还可分散患者注意力,减少对疼痛的关注,缓解由骨质疏松症引起的焦虑、抑郁等不利情绪。
4. 康复工程
行动不便者可选用拐杖、助行架等辅助器具,以提高行动能力,减少跌倒发生。此外,可进行适当的环境改造如将楼梯改为坡道,浴室增加扶手等,以增加安全性。骨质疏松性骨折患者可佩戴矫形器,以缓解疼痛,矫正姿势,预防再次骨折等。
总之,骨质疏松症是慢性病,涉及骨骼、肌肉等多种组织、器官,需要综合防治。在常规药物、手术等治疗的同时,积极、规范、综合的康复治疗除可改善骨强度、降低骨折发生外,还可促进患者生活、工作能力的恢复。
六
骨质疏松症防治监测
骨质疏松症是一种慢性疾病,其治疗是一个长期的过程,在接受治疗期间应对如下情况进行监测:疗效,钙和维生素D的摄入是否充足,药物的不良反应,对治疗的依从性和新出现的可能改变治疗预期效果的共患病。骨质疏松症药物治疗的目的是显著提高骨强度,从而降低骨折风险。临床上,对疗效的监测受限于缺少直接检测“骨强度”的临床工具,目前可使用替代指标监测疗效,如骨密度和骨转换标志物及脊椎影像学检查。
1. 治疗依从性监测
依从性差是骨质疏松症治疗中普遍存在的问题,提高依从性是防治诸如骨质疏松症等慢性无症状性疾病所面临的挑战。因为患者对疾病危害的认知度低,坚持治疗的积极性不够。时间愈久,愈易忽视,依从性越低,影响骨质疏松症的治疗效果。
提高骨质疏松症治疗的依从性需要有效的医患沟通,密切监测,及早发现存在的问题。树立有效治疗可降低骨折风险的信念,有助于维持患者良好的依从性;及时告知患者骨转换生化标志物和骨密度结果,并解释其与骨折风险下降相关,可鼓励患者坚持治疗;应用简便的治疗方案也有助于改善依从性。
2. 骨密度检测在疗效监测中的作用
尽管抗骨质疏松药物的长期抗骨折效力是否取决于其增加和维持骨密度的能力仍存有争议。但临床试验研究已经广泛采用DXA检测骨密度作为疗效判断的指标。连续检测骨密度已经成为临床实践中监测疗效的重要手段。
必须强调,使用抗骨吸收药物治疗时,骨密度的变化并非是预测骨折风险下降的敏感指标。研究显示,骨密度增加仅能解释双膦酸盐治疗相关的骨折风险下降的7%~18%和雷诺昔芬治疗相关的脊椎骨折风险下降的4%;而迪诺塞麦治疗36个月全髋骨密度变化可解释其降低新发椎体骨折风险的35%和降低非椎体骨折风险的84%。提示骨密度变化对解释骨折风险的下降在不同的药物是不同的,这也表明骨密度以外的其他因素对骨折风险下降可能更重要。早期监测骨密度的变化对预测抗骨吸收药物治疗反应的价值有限。而促骨形成药物治疗时,骨密度的增加对解释临床骨折风险的下降占有更大比重,如特立帕肽引起脊椎骨密度增加可解释脊椎骨折风险下降的30%~41%,骨密度的监测对促骨形成药物治疗疗效评估比抗骨吸收治疗有更大价值。
在治疗期间精确地发现骨密度变化,要求其变化大于测定的精确度误差(precision error)。从严格的统计学观点看,需监测95%置信区间的最小有意义变化值(least significant change, LSC),骨密度的变化值至少应为精确度误差的2.77倍。为了将精确度误差降至最低,连续骨密度测量最好在同一台仪器由同一技术员实施。如何评估精确度误差和计算LSC可参见网站(www.ISCD.org)。尽管将骨密度变化作为监测疗效的指标仍有争议,但美国国家骨质疏松基金会(National Osteoporosis Found-ation, NOF)和国际临床骨密度测量学会(International Socienty for Clinical Densitometry, ISCD)均推荐骨密度测量为治疗的常规监测指标。NOF建议应每两年进行一次重复测量骨密度,而ISCD提倡首次随访测定应在启动治疗或改变治疗后1年进行。但本指南仍推荐在药物首次治疗或改变治疗后每年、效果稳定后每1~2年重复骨密度测量,以监测疗效。
QCT测量的腰椎体积骨密度(vBMD)可用于监测男女两性与衰老、疾病和治疗相关的骨密度变化,但应根据体模数据建立其精确度。
pDXA、pQCT和QUS测量的外周骨骼并不能如脊椎和髋部对治疗有相同幅度的反应,故目前还不宜用于监测治疗反应。
3. 骨转换标志物在治疗监测中的作用
在抗骨质疏松药物治疗中,BTMs的变化明显早于骨密度。当用强效的抗骨吸收治疗时,BTMs快速下降,并于几个月内降至较低平台期,这种BTMs短期的下降与后续持久的骨密度变化和骨折风险的下降相关。而对促骨形成药物如特立帕肽,早期的骨形成标志物的升高预示着随后骨密度增加。监测中当患者BTMs的变化超过LSC时,才具临床意义。LSC是将BTMs测定的“精确度误差”乘以2.77得到的。为避免BTMs生物变异的影响,应采集禁食过夜标本。如重复测定,应在相同时间采集标本并在同一实验室检测。
4. 脊椎影像学检查
每年进行精确的身高测定对于判断骨质疏松症治疗疗效非常重要。当患者身高缩短2 cm以上,无论是急性还是渐进,均应进行脊椎影像学检查,以明确是否有新脊椎骨折发生。在为明确是否有椎体骨折而行首次脊椎影像学检查后,若再次出现提示新发椎体骨折的状况,如身高变矮、出现新的腰背痛、形体变化或在作胸X线检查时偶然发现新的脊椎畸形时,应再次行相应的脊椎影像学检查。若患者考虑短暂停药(药物假期),应重复进行脊椎影像学检查以明确有无新发椎体骨折;若治疗期间仍有新发椎体骨折,则表明需要更强的治疗或继续治疗,而不是考虑停药。
七
分级诊疗
骨质疏松症的分级诊疗,即按照疾病的轻、重、缓、急及治疗难易程度进行分级,不同级别的医疗机构承担不同疾病状况的治疗,实现基层首诊和双向转诊,以有效利用卫生资源,做好骨质疏松症的防控和管理,同时提高医疗卫生机构开展骨质疏松症预防控制的能力。
1. 骨质疏松症分级诊疗服务目标
以基层首诊、双向转诊、急慢分治、上下联动作为骨质疏松症分级诊疗的基本诊疗模式,逐步实现不同级别、不同类别医疗机构之间的有序转诊。指导患者合理就医、规范治疗,从而降低骨质疏松症及骨质疏松性骨折的发病率及其所致病死率。
2. 不同医疗机构骨质疏松症分级诊疗流程及分工
分级诊疗流程如(图5)所示,各级医疗机构在骨质疏松症诊疗中分工如下:
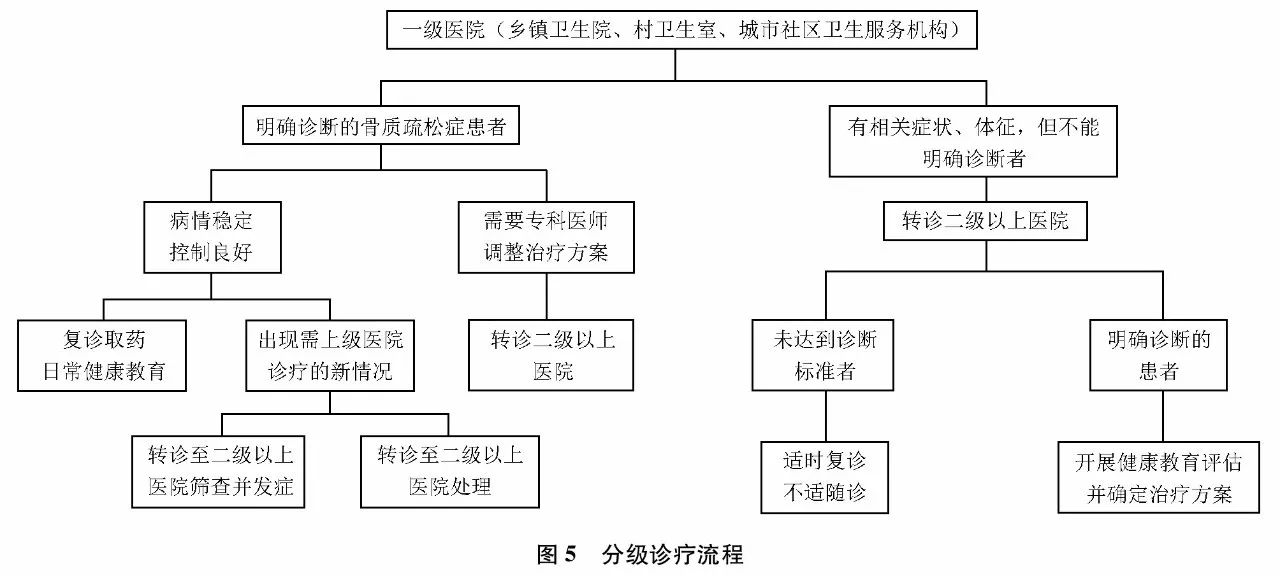
一级医院:乡镇卫生院、村卫生室、社区卫生服务机构等基层医疗卫生机构,通过建立居民健康档案、组织居民健康检查等多种方式开展骨质疏松症高危人群筛查,登记确诊的骨质疏松症患者。开展社区人群骨质疏松症及相关危险因素的健康教育;开展患者随访、基本治疗及康复治疗;对诊断不明者、严重并发症者及时转往上级医院诊疗。
二级医院:负责骨质疏松症临床初步诊断,按照诊疗指南、制定个体化治疗方案;诊断不明及重症者尽快转诊到三级医院诊治,对病情稳定者进行随诊。
三级医院:负责骨质疏松症确诊,根据需要完善相关检查,明确病因。开展综合及规范的治疗。治疗后病情稳定者可以转诊到一、二级医疗机构进行后续治疗、随访及康复。
本文来源:中华骨质疏松和骨矿盐疾病杂志 2017年9月 第10卷 第5期 413-444













