三尖瓣反流(tricuspid regurgitation,TR)是常见的心脏瓣膜疾病之一,其发病率随着年龄增长而增加,TR既往的标准治疗为外科手术,该方法创伤大、风险高,重度TR患者围术期死亡率可达10%。
近年来,经导管三尖瓣介入治疗(transcatheter tricuspid valve intervention, TTVI)技术取得重大突破,成为颇具前景的治疗新手段。2024年美国食品药品监督管理局(Food and Drug Administration,FDA)相继批准了一款经导管三尖瓣置换术(transcather tricuspid valve replacement,TTVR)器械及一款经导管三尖瓣缘对缘修复术(transcatheter edge-to-edge repair, TEER)器械,标志着TTVI进入了临床推广应用阶段。
我国目前尚无上市的TTVI器械,数个相关器械正处于临床试验中,TTVI在我国尚未进入推广应用阶段。国外相继发布了TTVI的专家观点文件,而我国尚无这一方面的共识性文件。为了增强我国同行对TR及TTVI系统的、客观的认识,明确我国TTVI发展方向,为该技术健康、规范化地发展做前期准备,中国医师协会心血管内科医师分会结构性心脏病学组组织有关专家,撰写了本共识。本共识提炼梳理了10个核心观点,有利于读者迅速掌握共识的精要。所有的核心观点都经过核心专家一致同意。
三尖瓣的解剖特征及TR的流行病学
典型的三尖瓣解剖包括3个小叶,其中隔瓣最小,从室间隔内侧发出,带有多个腱索;前叶最大,活动性最好;后叶通常有多个扇叶。三尖瓣经常存在变异,新近分类将三尖瓣分为4种类型:Ⅰ型有3个瓣叶;Ⅱ型有2个瓣叶;Ⅲ型有4个小叶(ⅢA型有2个前叶,ⅢB型有2个后叶,ⅢC型有2个隔叶);Ⅳ型具有>4个瓣叶。三尖瓣环非平面,呈椭圆形,在后间隔处最靠近心室,在前间隔处最靠近心房。三尖瓣叶由纤维状三尖瓣环、腱索、乳头肌和右心房右心室的心肌支撑。冠状窦位于右心房后隔瓣叶连合处附近,而右冠状动脉在房室沟绕前、后瓣叶处的三尖瓣瓣环走行,因此行经导管瓣环环缩手术时应避免过于靠近右冠状动脉。此外,房室结和右希氏束位于室间隔内,与隔瓣以及前隔瓣叶连合处相邻,TTVR时可能会损伤到房室结引起房室传导阻滞。下腔静脉在邻近三尖瓣处进入右心房,但不同患者下腔静脉与房间隔、三尖瓣环成角差异较大,给经股TTVI手术操作带来困难。
TR的患病率随着年龄的增长而增加,在65岁之后急剧上升。Framinghan研究显示70岁或以上男性和女性的TR患病率分别高达1.5%和5.6%,整个队列的患病率为0.8%。牛津瓣膜性心脏病人群研究(Oxford valve heart disease study,OxVALVE)招募了英国初级保健人群中2 500例65岁及以上的受试者,其中2.7%患有中度至重度TR。新近的社区调查研究显示,65岁及以上的人群中有7.2%的中度以上TR既往未被诊断。TR常在对左心疾病进行常规超声心动图检查时被发现,多达一半的严重二尖瓣反流患者和1/4的严重主动脉瓣狭窄患者会出现中度以上的TR。以上研究提示TR是一种高发却易被漏诊的疾病。
女性是TR严重程度及进展的预测因素。重度和进行性TR的其他临床预测因素包括肺动脉收缩压(pulmonary artery systolic pressure,PASP)升高和左心房扩大,这表明毛细血管前和毛细血管后肺动脉高压机制均促进该病程。一项荟萃研究显示,在调整PASP和右心室功能障碍后,中度/重度TR与较高的全因死亡率相关,同时也会升高心原性死亡率和心力衰竭的住院率;与无TR的患者相比,轻度、中度和重度TR患者的全因死亡率风险逐渐增加[相对风险比(relative ratio, RR)分别为1.25、1.61和3.44;P<0.001]。此结论得到了一项大规模人口研究的支持,研究纳入了澳大利亚接受超声心动图检查的439 558例患者,调整右心室收缩压、心房颤动和左心疾病后,与无TR者比,轻度TR[风险比(hazard ratio,HR)1.24]、中度TR(HR 1.72)或重度TR(HR 2.65)死亡率增加。另有一项研究显示,孤立性TR(无肺动脉高压、左心疾病及明显心脏原因)也是患者死亡增加的独立危险因素(RR 1.68)。这些研究结果证实TR并非一种良性疾病,而是患者预后的独立预测因素,其不良影响随着TR严重程度的增加而增大。
不同病因的TR患者预后差异很大。一项基于社区人群的大型研究将TR分为先天性(包括先天性三尖瓣异常或者先天性心脏病继发TR)、器质性(非先天性瓣叶器质性损伤)、左心瓣膜疾病(包括左心瓣膜疾病或其外科术后)、左心衰竭[左心室射血分数(left ventricular ejection fraction,LVEF)<50%且不合并左心瓣膜疾病]、肺动脉高压[PASP>50 mmHg(1 mmHg=0.133 kPa)且不合并上述异常]、孤立性(不符合上述异常),各组的平均年龄在61~79岁之间,发现其年死亡率最低的是先天性TR(5.5%),孤立性(12.1%)和器质性(22.2%)TR次之,左心瓣膜疾病(29.5%)、左心衰竭(28.1%)、肺动脉高压(26.9%)的患者预后最差。Wang等建立了继发性TR的1年死亡率预测模型,Dreyfus等建立了单纯TR外科术围术期死亡率的预测模型TRISCORE评分系统,两者是目前关于TR预后预测的较好模型。
我国尚无TR确切的流行病学研究。复旦大学附属中山医院一项入选13万例患者的超声心动图数据库显示,轻度、中度和重度TR的检出率分别为2.96%、2.22%和1.39%;TR的主要病因是左心瓣膜疾病(40%)和左心衰竭(30%),与上述国外研究相似。China DVD调查了在我国住院的瓣膜疾病患者,研究发现TR(16.5%)占比仅次于二尖瓣反流(26.9%),高于主动脉瓣反流(10.6%)、主动脉瓣狭窄(5.1%)和二尖瓣狭窄(3.1%)。
核心观点1:TR是最常见的心脏瓣膜疾病之一,发病率随年龄增长而增高;TR是患者预后的独立预测因素,合并左心疾病、肺动脉高压的TR患者预后更差。
TR有多种分类,如上述研究的分类。目前最为公认的分类是将TR分为原发性、室性继发性、房性继发性及心脏植入式电子装置(cardia implantable electronic device,CIED)相关性4大类,其发病机制及病因见表1。
表1 三尖瓣反流的发病机制及病因

核心观点2:TR按机制分为原发性、室性继发性、房性继发性及CIED相关性四大类。
药物治疗可以改善患者的症状,是TR的基础治疗方法。2020年美国心脏病学会(American College of Cardiology,ACC)瓣膜管理指南推荐,对于伴发右心衰竭的TR,建议使用利尿剂改善心原性的体循环充血症状(ⅡA类指征);对于有潜在的病因继发性TR,建议使用针对相关病因如左心衰竭、心房颤动及肺动脉高压的药物(ⅡA类指征)。左心衰竭继发的TR,首选给予指南推荐的抗心力衰竭药物治疗(guideline directed medical therapy,GDMT);毛细血管前肺动脉高压继发的TR,应该给予降低肺动脉压力的靶向药物治疗;而对于心房颤动导致的TR,恢复窦性心律对治疗TR可能有效,但证据有限。药物治疗仍然是TTVI术后重要的手段,如继续使用利尿剂,但可酌情逐步减少。外科手术后短期内,部分患者还需要正性肌力药物支持。在介入治疗前也应先给予充分的药物治疗。在进行TR器械研究中,应注意药物变化对症状的影响,在治疗前后尽量采取相同的药物治疗方案。对于原发性的TR,若病因能纠正,应针对病因进行治疗。对于CIED引起的TR,在评估确认为电极所引起,可考虑采取电极拔除及重置。不同病因的TR基础治疗策略见图1。
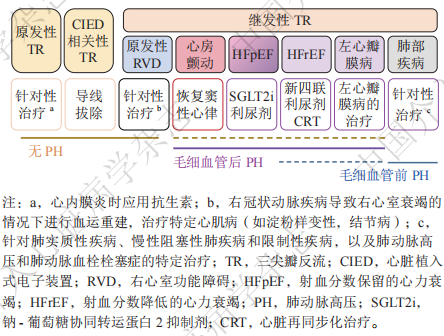
图1 不同病因的TR基础治疗策略
ACC及欧洲心脏病学会(European Society of Cardiology,ESC)指南均推荐,合并左心瓣膜疾病的TR患者在行左心瓣膜外科手术时同期处理三尖瓣(重度TR为Ⅰ类指征,中度TR为ⅡA类指征)。而对于孤立性的TR,指南推荐,原发性TR,若无严重右心室功能衰竭,可行单纯三尖瓣外科手术(有症状为Ⅰ类指征,无症状为ⅡA类指征);继发性TR,若无左心衰竭、右心严重衰竭及肺动脉高压,可行单纯三尖瓣外科手术(ⅡA类指征)。
实践中,三尖瓣外科手术通常在左心瓣膜手术中同时开展,单纯性三尖瓣外科手术仅占10%~20%,后者在美国10年间仅完成5 000例。TR早期患者耐受性较好、症状隐匿,待到接受外科干预时,患者一般情况已经较差,且常伴有多器官功能不全,致手术风险高。其中既往左心瓣膜手术后,再次单独行三尖瓣外科手术的院内死亡率10.6%;孤立性TR接受外科手术治疗院内死亡率为8.8%。对于纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅰ/Ⅱ级、无高危因素的早期患者,手术死亡率较低为1.7%。
核心观点3:药物治疗是症状性TR的基础治疗方法,可以改善患者的症状。利尿剂为主要药物,可根据患者不同病因给予其他药物及非药物治疗。
核心观点4:合并TR患者在行左心瓣膜外科手术时建议同期处理三尖瓣, 孤立性TR行单纯三尖瓣外科手术具有较高手术风险,需权衡风险获益比,尤其是对左心瓣膜手术后及右心功能较差者。
TR外科手术具有较高的风险,因此TTVI应运而生,发展迅速,为TR患者治疗提供了新的选择。目前TTVI的技术主要分为三大类:TEER、经导管三尖瓣环成形术和经TTVR(原位三尖瓣置换术及异位三尖瓣膜置入术)。ESC指南推荐,不适合外科手术,症状性、重度、继发TR的患者可以考虑在具有三尖瓣专业治疗经验的瓣膜疾病中心行TTVI(Ⅱb类指征)。
4.1 TEER
TEER通过夹合三尖瓣瓣叶来减少反流,是目前应用最广泛且证据最充分的TR介入治疗方法。TRILUMINATE Pivotal是评估TEER系统TriClip治疗症状性重度TR患者的多中心随机对照临床研究。该研究纳入350例TR患者,并以1﹕1的比例随机分配接受TEER或药物治疗。在30 d内,98.3%的患者在接受手术后没有发生重大不良事件;TEER组87%的患者TR减少至≤2+,药物组为4.8%。1年随访结果表明,TEER未降低全因死亡或三尖瓣外科手术、心力衰竭住院的复合终点事件,但相比药物治疗组,TEER组患者TR严重程度显著降低,生活质量也有所提高,美国堪萨斯城心肌病问卷调查(the Kansas city cardiomyopathy questionnaire,KCCQ)评分相较术前上升了(12.3±1.8)分。CLASP TR研究是一项单臂、多中心、前瞻性的评估TEER系统PASCAL早期可行性研究。研究纳入了65例患者,30 d死亡率为3.1%,术后1年,86%的患者TR下降至≤2+,6 min步行距离增加了94 m,KCCQ评分平均提高18分。以上研究证明了TEER对于外科手术高危、症状性、重度TR,安全性良好,能够明显减少TR,改善患者症状。
4.2 经导管三尖瓣环成形术
瓣环成形修复技术通过缩小扩大的三尖瓣瓣环来减少TR。这种技术适用于瓣环扩张导致的功能性TR。国际上获得欧盟(Conformite Europeenne,CE)批准的器械主要是Cardioband,临床试验表明其可以显著减少TR,并提高患者的生活质量。但该系统需要多个锚定点置入进行缩环,术式复杂,手术时间较长,限制了其在临床的应用。我国自主研发的K-Clip经导管三尖瓣成形系统,模仿了Kay’s瓣环成形术,采用夹合器折叠后瓣环,达到缩小瓣环内径,增加瓣叶对合,减少TR的目的。K-Clip 1年随访结果表明其在减少TR和改善心脏生活质量方面安全有效,且术式相对简单,有望在临床推广。
4.3 TTVR
瓣膜置换技术通过置入人工三尖瓣瓣膜来替代病变的三尖瓣。这种技术适用于瓣膜病变严重且其他治疗方法无效的患者。瓣膜置换可以是原位置换(EVOQUE,LuX-Valve/LuX-Valve Plus系统),也可以是异位置换(TricValve)。TRISCEND Ⅱ研究是一项比较EVOQUE系统和最佳药物治疗(optimal medical therapy,OMT)的随机对照试验。在30 d随访时间内,EVOQUE+OMT组3.2%的患者发生心血管病死亡,1.1%的患者发生心肌梗死,10.5%的患者严重出血,14.7%的患者出现需要长期起搏的心律失常和传导障碍,主要不良事件发生率27.4%,低于预期的43.8%,整体上满足主要安全终点。随访6个月,在单独使用OMT的组中,21.6%的患者TR降至中度以下,而在EVOQUE+OMT组中,98.8%的患者TR严重程度降至中度以下。与OMT相比,EVOQUE+OMT组患者具有更好的生活质量和心功能结果,NYHA分级明显改善,6 min步行距离提高30 m,KCCQ评分提高10分。
基于该临床研究结果,FDA批准了EVOQUE系统上市。LuX-Valve/LuX-Valve Plus系统是我国自主研发的新型TTVR装置。其中LuX-Valve经右心房置入,LuX-Valve Plus经颈静脉置入。LuX-Valve Plus的首次人体应用招募了10例被认为具有较高手术风险的重度TR患者,置入成功率达100%,除1例患者因房室传导阻滞植入起搏器外,未发生重大不良事件。2023年美国经导管心血管治疗学术会议(Transcatheter Cardiovascular Therapeutics,TCT)公布了TRAVEL Ⅱ研究的30 d结果,研究共纳入96例重度TR患者,有效性结果显示,80.4%的患者由术前NYHA心功能分级Ⅲ/Ⅳ级提升至Ⅰ/Ⅱ级,34.8%的患者KCCQ评分提升≥20分。严重不良事件发生率为5.2%,全因死亡率为1.1%。异位三尖瓣置入系统TricValve目前仍在临床研究阶段,小样本临床研究结果均显示良好的安全性及可行性。
此外,对于三尖瓣外科术后损毁的生物瓣,选择经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)使用的瓣膜如SAPIEN 3进行瓣中瓣置入术(Valve-in-Valve)是一种安全有效的选择。但TAVR瓣膜应用于经导管环中瓣置入术(Valve-in-Ring)结果尚不理想。
以上研究表明,在TTVI器械研究中,还未观察到TTVI在改善硬终点(死亡和心力衰竭再住院)方面的益处,这可能需要更大的样本量及更长的随访时间,然而TTVI在改善症状方面具有显著效果。选择何种TTVI治疗术式需根据患者的病理生理机制、三尖瓣的解剖特征以及临床特点制定个体化的策略。一般来说,TEER适合瓣叶对合间隙较小、瓣环成形术适合腱索拴系较轻的较早期TR患者,TTVR适合上述病变相对严重不能行TEER或瓣环成形患者,下腔静脉异位置入则适合病变较为晚期不能TTVR、中心静脉压力高的患者。每种经导管三尖瓣介入治疗术式的解剖适应证范围总结见表2。

核心观点5:对于外科手术高危、症状性、重度的TR患者,可在有经验的中心实施TTVI。选择TTVI时应考虑患者的局部解剖结构、病情严重程度和手术风险。
核心观点6:TTVI在降低TR严重程度、改善患者症状和生活质量方面安全有效,建议基于精准全面的术前评估选择有循证医学证据的器械,以达到最优效果。
核心观点7:建议TTVI器械的临床研究以改善症状和生活质量的指标为主要终点,同时关注生存率、心力衰竭再住院率及反流改善程度等重要短期和长期安全及疗效指标。建议使用三尖瓣学术联盟标准进行统一的临床研究终点定义。
TTVI术前筛选须了解三尖瓣相关解剖特征及发病机制,并进行临床、影像学及有创性评估。每例患者完整的术前筛选过程包括以上各项评估,综合评判后决定是否接受TTVI手术。
5.1 临床评估
TR可导致右心功能不全,与右心功能不全相关的临床表现可以包括以下几种:(1)系统性体液潴留,如颈静脉压升高,外周浮肿,腹水,肝大,肠道吸收功能减退;(2)收缩储备减少,心输出量降低,导致运动耐量下降,呼吸困难和疲劳;(3)房性或室性心律失常。此外,患者可伴有营养不良,贫血和认知功能降低。严重右心功能不全者可伴有慢性肾病(心肾综合征)和肝病(心肝综合征)。临床评估指标包括NYHA心功能分级、6 min步行试验、KCCQ指数、水肿指数、利尿剂指数等。欧洲心脏手术风险评估系统(European System for Cardiac Operative Risk Evaluation,EuroSCORE)-Ⅱ及美国胸外科医师协会(Society of Thoracic Surgeons,STS)评分中无单独三尖瓣外科手术的模块,用于评估三尖瓣外科手术时不够精确。TRISCORE是目前比较公认的三尖瓣外科手术评分系统。新近一项研究显示,TRISCORE评分也可以预测TTVI患者的2年生存率。
三尖瓣综合征是一种由重度TR所引起的全身性病理状态,包括心脏、肺、肝、消化、血液、皮肤和肾等多个系统的症状和并发症。目前建议将第1阶段定义为无临床症状,第2阶段仅有心脏症状,第3阶段出现任何心脏外表现,第4阶段涉及≥2个心脏外系统。这一概念强调了早期识别和治疗的重要性,半定量地评估了TR对患者的影响,并提出了一个基于患者症状和系统受累程度的风险分层框架,以指导更及时和个性化的医疗干预,从而改善患者的预后和生活质量。
5.2 影像学评估
影像学评估是TTVI术前评估的重点,包括经胸超声心动图(transthoracic echocardiography,TTE)、经食管超声心动图(transesophageal echocardiography,TEE)、多排计算机断层扫描(multislices computed tomography,MSCT)及磁共振成像(magnetic resonance imaging,MRI)评估等,综合判断患者TR反流量和病因、心脏解剖、心脏功能,以及指导置入器械的型号选择。
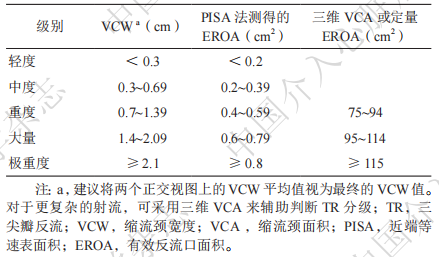
超声心动图可评估心脏形态结构和功能,对于TR病因的判断、瓣膜解剖和功能(三尖瓣及其他心脏瓣膜)、左心功能(主要为LVEF)及右心收缩功能[三尖瓣瓣环收缩期位移(tricuspid annular plane systolic excursion,TAPSE)数值],以及PASP等均具有快速、准确的评估作用。按照国际通用的标注,可以把TR分为五级,具体划分标准见表3。通过计算TAPSE/PASP指数得到右心室肺动脉耦联功能指数,可较好地预测TTVI术后的预后。对于三尖瓣TEER手术,TEE评估是患者术前影像评估的重点,可通过其掌握患者瓣叶及瓣环的解剖情况。术前TEE评估应包括从多个位置深度和多平面角度进行成像,并从食管中段水平开始。三尖瓣瓣叶间隙及反流位置是三尖瓣TEER术后效果重要的预测因子。
表3 TR的超声分级标准
MSCT是TTVR术前评估心脏解剖结构最主要的方法,是判断患者是否适合TTVR手术及人工瓣膜规格选择的主要参考依据。测量数据包括:瓣环尺寸(周长及面积)、瓣环与室间隔夹角、间隔锚定区(使用Lux-Valve瓣膜)、瓣环上10 mm右心房横径、右心室径线、冠状动脉与瓣环关系及血管入路评估。对于异位三尖瓣置入患者,还应评估肺动脉和上、下腔静脉及其分支的情况。除上述心血管解剖学特征外,心内异体成分,如有线起搏器导线的位置、数量、走行,无线起搏器的位置,均可能影响三尖瓣人工瓣膜的置入,需同时进行评估。
MRI在测量右心室大小及右心室功能方面具有更高的准确性,当超声心动图图像被怀疑低估了TR或右心室功能障碍的程度时,MRI成像评估具有较高价值。右心室收缩功能的基线评估对于TTVR更有价值,因为后者在完全消除TR后可出现急性后负荷增加,导致右心衰竭恶化的风险。
5. 3 有创性评估
有创性评估手段包括右心导管(包括肺动脉压力、肺血管阻力、肺小动脉楔压及心排指数等)及血管造影检查。超声心动图对PASP的评估通常会低估重度TR患者的肺动脉高压严重程度(在此TR状态下简化的伯努利方程不成立),因此无法准确量化肺动脉压力梯度。建议在术前(可在介入手术当天同台测量)进行有创肺动脉压力测量,以减轻TTVR术后由于肺动脉高压导致的急性右心功能衰竭的风险。
5. 4 TTVI指征综合评估
综上,对于适合TTVI患者的参考建议包括5个方面:(1)患者经过充分药物治疗效果后仍有临床症状,包括右心衰竭的症状或者活动后气促;(2)无严重的肺动脉高压和右心功能衰竭,推荐PASP<65 mmHg,TAPSE≥12 mm;(3)左心功能无严重减退,LVEF>45%(左心功能异常者建议以改善左心衰竭治疗为主);(4)解剖合适(表2);(5)外科手术高危或者不适合外科手术。
核心观点8:TTVI术前筛选须了解三尖瓣相关解剖特征及发病机制,并进行临床、影像学及有创性评估,注意评估肺动脉压力、右心功能和左心功能情况,综合评判后决定是否适合TTVI手术。
核心观点9:影像学评估主要包括超声及CT评估,对于行TEER患者建议行TEE以详细评估瓣叶及瓣环解剖,对于行TTVR和瓣环成形介入术患者应行CT血管造影检查,全面评估三尖瓣、右心及入路的解剖。
临床研究终点是评估临床试验效果的重要指标,对于TR的治疗研究来说,这些终点有助于标准化临床试验,并在不同研究之间进行比较,衡量不同治疗方法的有效性和安全性,为TR的临床研究提供明确的评估标准。为了规范TTVI的临床研究,三尖瓣学术联盟(Tricuspid Valve Academic Research Consortium,TVARC)发布了TR临床试验的标准定义。首先,临床研究随访时间应足够长,以确保TR治疗的有效性和安全性,并至少在入院后、30 d和1年统计并记录临床结果,常见的安全终点经常出现在入院后和30 d的时间点。同时,证明器械有效性的临床疗效终点建议在至少1年的随访后进行评估。疗效终点包括全因死亡率、心血管死亡率、心力衰竭再住院率及以患者为中心的临床终点、影像学终点及生物标志物和器官功能。
6. 1 全因死亡率和心血管死亡率
尽管心血管死亡率是TR总死亡率的重要组成部分,但在TR患者中区分心血管和非心血管死亡可能具有挑战性,因为右心衰竭通常伴有心肾和心肝综合征。因此,在TR治疗试验中建议将全因死亡率作为主要死亡终点之一,而心血管死亡率判定为次要终点。
6. 2 住院终点
TR和右心衰竭与较高的住院率相关。根据心力衰竭合作与学术研究联盟的规定,临床研究应报告全因住院以及心血管和心力衰竭住院,住院治疗也应区分为瓣膜(自体瓣膜或人工瓣膜)和(或)手术相关。
6. 3 以患者为中心的临床终点
患者健康状态(即症状、心功能和生活质量)的改善是疾病治疗的核心目标。因此,FDA提出仅根据健康状况的改善就可以证明治疗的有效性,包括KCCQ评分、6 min步行试验及NYHA心功能分级等。如前所述,目前TTVI研究难以证明硬终点改善,建议以该终点为主要终点。KCCQ的变化是目前较公认的指标,提升5、10和20分代表患者生活质量的小幅、中幅和大幅改善。但是,非盲试验和假对照试验中的安慰剂效应仍然是该测量方法的主要缺陷。6 min步行试验也是主要的观察指标,一般来说,6 min步行试验增加30~50 m被认为是显著的临床改善。
6. 4 影像学终点
TR减少或消失是主要的影像学终点,而超声心动图是术前和术后评估TR分级的首选检查方法。可通过经食管四维超声心动图或全周期CT成像评估瓣叶漂移、增厚和瓣叶面积,以确认瓣叶功能是否正常或是否存在瓣叶血栓或受限的证据。此外,心排血量,肝静脉血流回流,右心室功能,右心室/右心房重塑为次要影像学终点,可通过超声等手段进行评估。
6. 5 循环生物及器官功能标志物
与右心功能及TR确切相关的生物标志物相对较少。重度TR可导致右心容积负荷、心肌拉伸与应激,从而使B型脑钠肽(B-type natriuretic peptide,BNP)释放增加。同时由于重度TR导致的体循环淤血可影响肝肾功能,因此术前肝肾功能相关循环标志物与TR也存在一定相关性,并可作为手术成功和临床结果的预测因素。然而,这些生物标志物与TR的严重程度及临床预后的具体相关性目前尚不清楚。
6. 6 成功终点
TVARC区分了手术中的技术成功、术后手术结果相关的临床成功。术中的技术成功定义为在不存在严重并发症的情况下成功置入人工器械并发挥即时功能,将术后临床成功定义为人工瓣膜正确定位、功能正常且不存在与手术相关的并发症、需要重新干预、或因基础疾病而再次入院等因素。临床成功(术后30 d以上)包括持续的瓣膜性能以及主要不良事件、临床结果、功能状态和生活质量指标。
安全终点主要关注术后并发症发生情况。所有的器械的植入都存在相关风险和注意事项。
7. 1 三尖瓣再干预
定义为非计划内的,因三尖瓣术后新发的或持续的瓣膜或置入器械功能不全所导致的再次经导管或外科干预,如瓣周漏、器械衰败、急性栓塞等。
7. 2 出血
和其他类型的瓣膜研究相似,出血是TTVI常见的并发症,尤其在TTVR中发生概率可达10%。三尖瓣介入治疗过程中,存在胸腔、心包出血、上下腔静脉、右心房及右心室破裂出血以及消化道出血的可能。TR患者大多病程较长,右心房壁组织薄弱、张力大,静脉压高,肝淤血,凝血功能差,这些因素均易导致出血并发症。因此,术前应积极纠正凝血功能,调整血容量,降低静脉压;术中轻柔操作,仔细止血是避免术后胸腔出血有效的预防措施。部分患者TTVR后会出现消化道出血,这和胃肠道淤血、凝血功能较差、进行抗凝或抗栓治疗有关。总之,出血预防的重点是在术前对患者的凝血功能做好评估,术后积极检测凝血功能指标,做好随访及抗凝的指导。
7. 3 血管并发症
定义为与血管通路相关的并发症,如血管离断、血管夹层、狭窄、穿孔、破裂、动静脉瘘、假性动脉瘤、血肿或感染等。术前应仔细评估入路血管,选择合适的路径及产品可降低入路血管损伤风险。
7. 4 传导阻滞及起搏器植入
在早期可行性研究中,TTVI后起搏器植入率在TEER和瓣环成形术后均较低,但在TTVR后起搏器植入发生率为11%~14%,这是因为依靠径向支撑力锚定的人工瓣膜会对传导束产生不同程度的挤压损伤,从而造成传导阻滞。Lux-valve不依靠径向支撑力锚定,在这方面的并发症发生率更低,小于3%。
7. 5 肾功能不全
TR患者多病程长,心功能差,长期肾灌注不足及静脉系统高压导致肾功能损伤,术前常合并不同程度的慢性肾功能不全。术中对比剂的应用,术中术后出血、输血,术后早期心功能下降,术后抗生素的使用均会导致术后肾功能损伤进一步加剧。术后肾功能衰竭是术后高死亡率的重要因素,因此应尽量避免上述情况的发生。应在术后密切关注患者尿量及内环境的变化,若出现少尿、无尿,或血钾及血肌酐持续升高,应积极行肾代替治疗,防止肾功能进一步恶化。
7. 6 急性右心功能减退
虽然TTVR解决了反流问题,但其可导致术后右心室后负荷的增加。虽然术后右心室舒张末期内径可显著减小,但反应右心室收缩功能的超声心动图参数(如TAPSE)并没有明显改善,甚至术后早期会有下降。此外,由于TR的消除,右心前向血流增加也会导致出现左心前负荷的增加,若术前左心室功能不佳,术后则可能加重,出现急性左心衰竭。因此,术前应严格筛选患者,严重左心或右心功能不全,及重度肺动脉高压的患者并不适合行TTVR手术。同时需加强围术期的管理,术前积极强心、利尿,加强营养支持,待低蛋白血症纠正,肝、肾功能好转,水肿减轻后手术。术后血管活性药物维持时间应适当延长,尤其是米力农,其使用能有效降低肺动脉压力,利于右心功能恢复。对于少尿、无尿,及尿素氮和肌酐进行性增高的患者,应尽早进行血液透析治疗。
7. 7 器械相关并发症
TTVR的器械相关并发症包括瓣膜移位、瓣周漏、瓣膜血栓及瓣膜功能障碍。这些并发症的定义与瓣膜学术研究联盟(Valve Academic Research Consortium,VARC)标准相似。其发生与患者和器械型号尺寸不匹配,及操作不当有关,还与不成熟的器械存在产品缺陷相关。TEER相关的器械并发症包括瓣叶撕裂、单边脱落(3.8%~7.0%),其发生概率相对于二尖瓣TEER高,可导致手术效果欠佳或反流复发,但一般很少需要外科手术干预。
7. 8 其他并发症
其他并发症包括深静脉血栓及肺栓塞、脑神经损伤、血小板减少等。由于TTVR仍处于初期探索阶段,其所有并发症尚不完全清楚,有待将来进一步研究。
核心观点10:三尖瓣介入治疗目前处于初步发展阶段,应该选择合适患者,手术团队应经过严格系统培训以减少并发症发生。
总之,TR发病率高且对患者预后影响明显,因外科手术具有风险高的局限性,安全性更高的TTVI具有良好的应用前景。然而TR具有不同病因及发病机制,病程长且患者耐受性相对良好,导致不同TR患者异质性大。包括临床、影像及血流动力学在内的综合评估有利于选择合适患者,提高患者手术的疗效。目前的TEER安全性高,但长期效果有待确认,而TTVR效果良好,但应用经验相对有限。对于TTVI,仍需要在临床研究证据、适应证选择、影像学引导、手术经验积累、并发症防治、器械研发等方面累积更多的经验。
参考文献:略
-END-
声明:本文转载于<中国介入心脏病学杂志>,仅用于学习交流,版权归原作者所有。如有侵权违规,请立即联系我们。













