心脏瓣膜置换术是治疗瓣膜性心脏病的关键方法,能够显著改善心脏功能、延长患者寿命并提升生活质量。然而,瓣周漏或瓣周反流是此类手术后较常见的并发症之一,具体是指缝合环与周围瓣环组织之间的病理性反流。这种情况的发生率为2.3%至17%,且是心脏瓣膜置换术后特有的并发症,也是患者需要进行换瓣再手术的主要原因。
有研究指出,二尖瓣发生瓣周漏的比例高于主动脉瓣,而在三尖瓣和肺动脉瓣中很少见。同时,机械瓣和生物瓣在瓣周漏发生率上没有显著差异。

发生机制
瓣周漏可能在心脏瓣膜置换术后的任何时期出现,其中大多数严重的病例发生在术后半年内。导致瓣周漏的原因多种多样,包括以下几方面:

临床表现
多数轻微瓣周漏的患者通常没有明显的临床症状。当反流较为明显时,患者可能会出现乏力、头晕、发热等症状。具体来说,二尖瓣瓣周漏在听诊时常表现为胸骨左缘的收缩期杂音,而主动脉瓣周漏则表现为舒张期杂音。
对于心脏瓣膜替换术后的患者,如果在听诊时发现类似杂音,应首先考虑瓣周漏的可能性,并进一步进行影像学检查。此外,一些患者可能会出现溶血性贫血和心功能不全的症状。

超声表现
超声心动图检查在评估人工瓣膜置换术后瓣周漏方面具有重要意义,是首选的影像学评估方法。它不仅能够确定瓣周漏的发生部位,还可以测量瓣周漏裂隙的大小、反流束缩流颈宽度以及反流束面积等指标,并能判断是否合并血栓、赘生物或感染性心内膜炎。此外,超声心动图还可以指导瓣周漏的介入治疗。
经胸超声心动图(TTE)是发现瓣周漏的常用方法,虽然二维图像的敏感度较低,仅在部分病例中能清楚显示瓣周裂隙,但对于较大的瓣周漏,二维图像可以直接显示瓣周回声中断或瓣膜撕脱。主动脉瓣位瓣周反流的起源和空间分布可以通过胸骨旁心底短轴和左心室长轴切面来判定,而二尖瓣位瓣周反流的起源和空间分布则可以通过心尖四腔心和心尖左心室长轴等切面来判定。
彩色多普勒血流成像(CDFI)在发现位于瓣架之外的反流束方面比较敏感,是诊断瓣周漏的主要依据。瓣周漏通常表现为起源于人工瓣瓣环外、宽而长的多彩湍流,且持续时间较长。中度以上的瓣周漏在缝合环上方可以见到血流汇聚区及延展到下方心腔内的反流束。不同于自体瓣膜关闭不全导致的反流,瓣周漏导致的跨瓣反流为偏心性反流,超声心动图往往低估其严重程度。
经食管超声心动图(TEE)比TTE更能清楚地显示漏口大小、位置及微小反流束。TEE联合三维超声是目前公认的诊断瓣周漏的最佳方法,可以对瓣周漏的位置、形态、数量和反流情况进行精准评估,同时还能进一步指导瓣周漏的介入治疗。利用三维超声,可以清晰显示瓣周漏的形态,通常为卵圆形或新月形,结合CDFI可以对瓣周漏区域的反流量、流速、压力及反流面积进行详细评估。
在临床工作中,TTE和TEE两种检查方法是互为补充的。TTE对于发现主动脉瓣位人工瓣周漏比较敏感,而TEE对于发现二尖瓣位人工瓣周漏更为有效。由于TTE检查时,二尖瓣瓣周反流位于人工瓣膜后方,声影因素影响了对瓣周反流的准确判断,而TEE由于其特殊的角度可以从左心房面观察二尖瓣人工瓣膜,克服了这一限制。
在存在显著反流的人工瓣膜时,TTE很少漏诊。如果怀疑患者患有感染性心内膜炎或患者出现呼吸困难,而TTE结果为阴性时,应该进行TEE检查。然而,TEE不应作为常规检查手段,而应在特定情况下使用,以确保全面准确的诊断。
尽管人工瓣膜的瓣周反流大多是异常的,但细小的瓣周反流在术后早期非常常见,通常是微小而多束的反流,无法准确定量,也没有明显的临床意义。从广义上讲,指南中用于判断自体瓣膜关闭不全的方法和定量方法也可用于人工心脏瓣膜,但操作上稍有难度。
可以通过瓣周反流所占瓣膜缝环的圆周比例大致判断反流的严重程度。借助瓣环水平的搏出量测定的反流量或反流分数可用于判断人工主动脉瓣的反流,但这方法不适用于测量人工二尖瓣的反流。
实时三维TEE的使用可能更有助于人工瓣膜反流的定量分析,提供更精确的评估。

中心性反流与瓣周漏
指起源于人造瓣环以内的反流,多数起自碟片与瓣环的接触缘。中心性反流可分为“生理性”和“病理性”两类。“生理性”反流在人造瓣中普遍存在,CDFI(彩色多普勒血流成像)显示这种反流可为一束或多束,一般较细。病理性反流则是指人造瓣关闭不良所造成的反流,CDFI显示反流束较宽,连续波多普勒(CW)测得的反流速度较高。
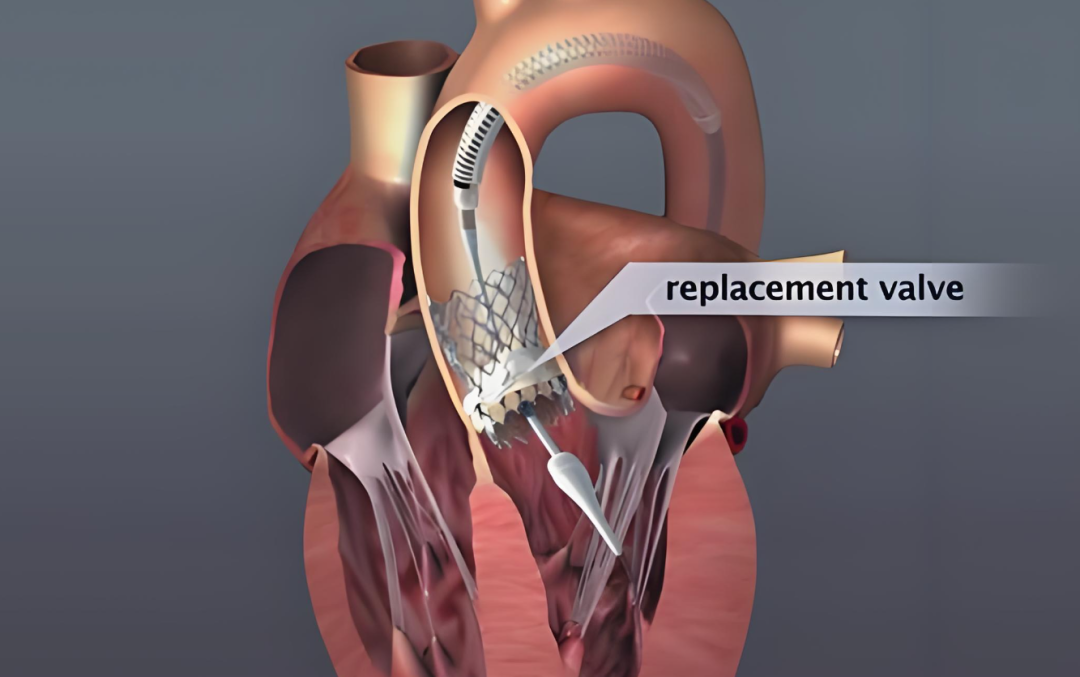
指人造瓣环(缝合环)与人体瓣环组织之间的反流,CDFI显示反流束起自人体瓣环组织与缝合环之间的裂隙处。
需要注意的是,区分中心性反流与瓣周漏的标准,不应仅根据反流束在受血心腔分布是否偏心,而应根据反流束的起始位置。

瓣周漏的外科治疗及介入治疗
在不伴有感染性心内膜炎的情况下,细微瓣周反流通常无临床或血流动力学意义,并且预后良好。没有证据表明这些细微瓣周反流会增加感染性心内膜炎的风险,但偶尔会因红细胞破坏导致溶血性贫血。
大的瓣周漏没有自发闭合的倾向,且随着人工瓣膜活动,特别是在左房室腔显著扩大和瓣环有病变时,存在扩大的趋势。此外,瓣周漏容易并发人工瓣膜心内膜炎,因此应积极治疗。过去,瓣周漏的治疗主要依靠外科手术,手术方式包括修补术和再次人工瓣膜置换术。二次外科修复或二次换瓣依然是治疗瓣周漏的主要方法,但二次手术技术难度大,风险高,手术死亡率高,许多外科医生和患者都不愿选择二次手术。
自1992年以来,已有多例经股动脉穿刺放置封堵伞闭合瓣周漏成功的报道。手术成功的关键在于术前及术中对瓣周漏位置、形态、大小及其与周边解剖关系的准确评估,因此术前三维超声及多排CT三维重建十分重要。
对于感染性心内膜炎引起的瓣周漏,首选外科手术;对于非感染性的瓣周漏,导管封堵是安全有效的选择,创伤小、恢复快。
-END-
声明:本文转载于<瓣膜网>,仅用于学习交流,版权归原作者所有。如有侵权违规,请立即联系我们。