

静脉-动脉体外膜肺氧合(venous-arterial extracorporeal membrane oxygenation, V-A ECMO)在难治性心脏骤停(cardiac arrest, CA)中已得到广泛应用。我国急诊医学专家团队在 2018 年发表的《成人体外心肺复苏专家共识》[1] 中,系统阐述实施成人体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)过程中的关键问题, 大大推进了国内急诊 ECPR 技术的开展。
我国 ECPR 的发展远未满足临床需求,仍处于高速发展期,存在地域不均衡、部分医院缺乏经验、在基础条件不具备的情况下急于开展等情况,加之 ECPR 发展迅速,基于上述情况,本文结合新近文献及临床实践对 2018 年共识进行补充及更新。
欧洲、北美、日本和韩国对 ECPR 的研究较为领先。欧洲的注册研究显示 2011 年 5 月到 2018 年 1 月间发生的可疑心源性院外心脏骤停(out-of-hospital cardiac arrest, OHCA)中大约 4% 的患者使用了 ECPR[2]。截止 2022 年 10 月,体外生命支持组织注册的成人 ECPR 病例共 12 125 例,其中 42% 的患者能成功撤除 V-A ECMO,30% 能够出院或者等候至器官移植 [3]。
目前国内部分地区已经建成了区域性 ECPR 中心,且获得了良好的治疗效果。南京医科大学第一附属医院急诊中心 2015—2022 年 OHCA 患者出院存活率 22.5%,存活患者中 77.8% 神经功能预后良好 [4]。然而,部分医疗结构技术不全面、受制于伦理及费用昂贵等,ECPR 技术的发展仍处于瓶颈期。建立完备的分级转诊机制、做好定期专业培训、资质认证和后续质量控制将成为我国 ECPR 技术健康持续发展的关键。
ECPR 联合其他急救技术的集束化治疗
可能有助于改善患者预后
ECPR开始后,即使尚未恢复自主循环(return of spontaneous circulation, ROSC),体外循环仍可为全身脏器提供灌注。与传统心肺复苏(cardiopulmonary resuscitation, CPR)相比,ECPR 能够提高冠状动脉的灌注压、ROSC 率[5]以及除颤成功率 [6],并且能够改善血流动力学状态,如颈动脉血流量,减少心肌梗死面积 [7]。ECPR 能够提供充足的器官灌注,减少缺血缺氧性脑病的风险。
CA 的治疗非常复杂,往往涉及多个学科的技术交叉。V-A ECMO、目标温度管理(target temperature management, TTM)、经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)等复杂技术均可应用于 CA 患者。V-AECMO 的热交换器也能够应用于 TTM,减少再灌注损伤,并减轻继发性脑损伤。国内及国外学者均有报道 ECPR 联合 TTM 可改善难治性 CA 患者预后,患者取得良好的神经功能预后 [8-9]。Pang 等 [10] 研究了 TTM 在接受 ECPR 治疗的难治性 OHCA 患者中的重要性,这项回顾性研究显示,接受 ECPR 和 TTM 的患者的出院存活率和神经功能预后均有显著改善。与常温下的 ECPR 相比,低温组的神经功能预后较好,患者的出院存活率更高(42.9% vs. 15.4%,P=0.020)。从 CA 到温度达标的时间越短,患者的神经功能预后越好[11]。由于 ECPR 能够提供稳定的全身灌注,即使发生持续性室颤,使用 ECPR 的患者也能进行 PCI[12]。CHEER 试验 [13] 纳入了 26 例 30 min 内未能 ROSC 的院内心脏骤停(in-hospital cardiac arrest,IHCA)及 OHCA 患者,使用机械心肺复苏、TTM、V-A ECMO 以及对可疑冠状动脉闭塞的患者进行冠脉介入等技术,其中 14 例患者出院时神经功能完全恢复。这项研究提示 CA 后包括 V-A ECMO 的集束化治疗可能有效改善患者预后。
推荐意见 1:根据 CA 患者情况,ECPR 可联合 TTM、冠状动脉介入治疗等实施集束化治疗,以期改善患者预后。
目前尚无统一的 ECPR 适应证。2019 年美国心脏病协会(AHA)指南更新中指出目前没有足够证据推荐 CA 患者常规使用 ECPR,但传统 CPR 失败且有熟练医生快速实施 ECPR 时可对选择的患者实施 ECPR[14]。随后在 2020 年,AHA 指南对 ECPR 的适应证进行了更新: 目前没有足够证据支持对 CA 患者使用 ECPR,但在一定的复苏时间窗内,对于那些选定的,由于可逆原因导致的 CA 患者,专业人 员可尝试 ECPR 进行抢救 [15]。
相较 2018 年《成人体外心肺复苏专家共识》,本期专家共识更推荐初始心律为室速/室颤(ventricular tachycardia/ventricular fibrillation, VT/VF) 的可电击心律的CA患者使用ECPR治疗。Maeda等[16] 发现,ECPR 转机前心律为非可电击心律的患者,其院内病死率明显高于 ECPR 转机前心律为可电击心律的患者(OR=5.42, 95%CI :2.11~15.36 ;P<0.001)。Kawashima 等[17]发现初始心律为 VT/VF 的 CA 患者实施 ECPR 可产生 3.32 质量调整生命年,初始心律为心脏停搏/无脉电活动的 CA 患者实施 ECPR 只产生 1.17 质量调整生命年,而后者的花费是前者的两倍左右。这些研究提示初始心律为 VT/VF 的 CA 患者可能获得更好的成本效益比。
缩短 CA 患者低流量时间有利于改善患者存活及神经功能预后。Lauridsen 等 [18] 研究发现 ECPR 前暂停的胸外按压时间每增加 5 s,该患者的生存率及神经功能预后都随之显著恶化。Yukawa 等 [19] 发现 OHCA 患者获得良好神经功能与从 CA 到 V-A ECMO 的时间明显缩短密切相关(中位时间 33 min vs. 46 min)。当 CA 到 ECMO 时间超过 40 min 时,良好神经功能预后的生存率从 30% 以上迅速下降到约 15%。因此,最佳 OHCA 到 V-A ECMO 时间的界值可能为 40 min。然而,ECMO 开始前的 CPR 持续时间是 ECPR 治疗 CA 患者取得良好神经功能预后的关键因素和独立因素。因此,OHCA 患者 ECPR 开始前的 CPR 持续时间限制可能在 40 min 左右。Bartos 等[20]使用明尼苏达大学的 ECPR 流程,对 VT/VF 的 OHCA 患者进行研究,发现在 CPR 进行 60 min 以内,使用 ECPR 的患者神经功能结局要明显优于传统 CPR 的患者。CPR 持续 60 min 以上的患者其使用 ECPR 后病死率或神经功能不良的相对风险显著降低。CA 60 min 以上 V-A ECMO 转机的患者获得良好神经功能预后的病例已有报道 [21]。如果 OHCA 患者相对年轻,有目击者且无终末期疾病,导致 CA 的疾病可逆,超过 40 min 后仍可考虑启动 ECPR。对于 IHCA 患者,如果 60 min 内实施 ECPR,生存率及神经系统预后可能均存在潜在获益 [22]。
推荐意见 2:初始心律为 VT/VF 的 CA 患者更推荐使用 ECPR。
推荐意见 3:OHCA 患者 CPR 持续 40 min 以内实施 ECPR。对于年轻、有目击者、无终末期疾病且评估病因可逆的 CA 患者,在初始 60 min 内,应当积极考虑 ECPR。
ECPR 在实际操作层面涉及多个专业领域,特别是对于已经发生难治性 CA 患者而言,其机体已经出现了多系统功能的严重紊乱,由单一专业团队处理很有可能会出现抢救效率下降的窘境,因此,多学科团队协作(multi- disciplinary team, MDT)的组建与协调就显得尤为重要 [23]。
我国使用 ECMO 的科室涵盖了心脏外科、心血管内科、重症医学科、麻醉科、体外循环科、急诊科与呼吸科等多个科室 [24]。我国不同医疗中心根据自身情况摸索出适合的 MDT 团队特色。由于缩短 V-A ECMO 启动时间意义重大, 北京大学第三医院形成了以急诊科为主导的 ECPR 团队,该抢救团队可以全天保持待岗状态。MDT 中涵盖了心血管内外科、呼吸科、重症医学科等核心高年资专家,并会根据患者病情扩展为对 ECMO 技术熟悉的肾内科、神经内科与检验科等专业的专家。此种模式在临床实践中获得了良好效果,通常在 CA 现场第一目击者启动 CPR 后,在 30 min 内可以完成 ECMO 的运转,有效地提高了抢救效率和 ECMO 后期脱机率。这种模式与美国密歇根大学医学中心急救部采用的模式非常接近,即在 ECPR 的 MDT 中分成急诊医生、外科医生、灌注师、内科医生、专职护士等模块,各司其职,完成流程中的各岗位要求 [23]。
推荐意见 4:ECPR 医疗中心可根据本中心特点组建 ECPR 多学科团队,以提高 ECPR 的治疗效果。
近年来,移动 ECMO 设备可允许更快速地实施 ECPR。由于神经功能预后随着院外复苏时间延长而恶化,当低灌注时间成为关注的要点时,移动 ECPR 设备可以减少低灌注的时间。明尼苏达复苏中心的移动 ECPR 团队全天候待命,急救人员发现需要 ECPR 的患者后,立刻呼叫该团队,复苏团队与急救人员在最近的医学中心急诊室会合,为患者进行 ECPR,患者随后被送往医院的心导管室,经冠脉造影或 PCI 后,被送往复苏中心或 V-A ECMO 中心进行复杂的 CPR 后管理和 V-A ECMO 管理 [25]。
推荐意见 5:移动 ECMO 设备可应用于 ECPR,以减少院外复苏低灌注时间。
超声能够在 CA 情况下快速识别动、静脉,为动、静脉导管的置入提供了精确、可靠的参考,超声引导下置管能够显著减少血管并发症 [26]。ECPR 后即刻可在超声引导下进行股动脉插管,连接远端灌注管置入股浅动脉,可以减少肢体急性缺血损伤的发生率 [27]。用近红外光谱法可以实时监测插管肢体的血运,有助于缺血的早期诊断和恢复逆转 [28]。
推荐意见 6:移动的超声设备可广泛应用于 ECMO 股动脉置管,提高时间利用率及成功率。
在使用外周 V-A ECMO 期间,逆行的动脉灌注会增加左室后负荷从而影响左心功能。主动脉内球囊反搏(intra-aortic balloon pump, IABP)能够增加舒张压 [29],极大提高大脑中动脉的前向平均血流 [30],增加冠状动脉血流灌注,同时能够降低 V-A ECMO 的左心室负荷,在心源性休克的患者中 IABP 联合外周 V-A ECMO 能够降低病死率并提高 V-A ECMO 的脱机率 [31]。虽然部分 ECPR 的研究使用了 V-A ECMO 和 IABP 的组合,但 IABP 对神经功能是否有保护作用尚不明确。
容量优化管理在 ECPR 运行期间至关重要,一旦启动 V-A ECMO,就应当立即启动容量优化策略 [32]。通过使用肾脏替代治疗(renal replacement therapy, RRT)可以获得最佳的液体状态,V-A ECMO 联合 RRT 是 CA 患者的重要治疗手段 [33]。V-A ECMO 支持的患者若需要 RRT,可直接将透析过滤器连至 V-A ECMO 回路中,能够为 CA 患者提供高效的床旁支持治疗 [34]。在促进呼吸、循环系统恢复的同时,清除机体内毒素与多余水分,达到减轻心肺负担,促进各脏器功能恢复的目的,但也会增加感染、血栓形成和出血等并发症的风险 [35]。
推荐意见 7:V-A ECMO 患者如出现左心室后负荷明显增加,可选择使用 IABP。
推荐意见 8:可使用 RRT 在 ECMO 运行期间优化容量管理。
撤除 V-A ECMO 的决策需要一系列考量,包括患者临床症状、生命体征、血流动力学和影像学是否好转,同时需要尽可能解决 CA 的潜在病因。难治性 VT/VF 中严重冠状动脉疾病是大多数患者 CA 的病因。因此,心脏功能恢复通常是 V-A ECMO 拔管的核心标准 [33]。具体撤机标准可参照 2018 版《成人体外心肺复苏专家共识》。可以采用降低流量、建立侧枝循环、泵控逆流试验等方法进行脱机试验 [36]。乳酸 >24 mmol/L 或者乳酸 >16 mmol/L 且 pH<6.828 可作为终止体外心肺复苏的一项指标 [37]。
除 2018 版《成人体外心肺复苏专家共识》所阐述 ECPR 的并发症外,“南北综合征”是外周 V-A ECMO 治疗的特有并发症。V-A ECMO 一般选择股静脉作为引流通 路,股动脉作为灌注通路,心脏泵出的顺向血流与外周 V-A ECMO 的逆向血流存在交会平面。氧合充分的逆向血往往很难供应机体上半身,而顺向血流氧合不良,导致机体出现上半身缺氧,影响重要脏器供氧,可导致脑缺血及心肌缺血,将这种并发症称为“南北综合征”(又成为 Harlequin 综合征或 BlueHead 综合征)。南北综合征通常发生在心脏本身的收缩能力逐渐恢复的过程中。可使用脉搏血氧饱和度测定法或动脉血气测量法密切监测头臂动脉,如右手、手臂或面部的血氧饱和度。在大多数情况下,“南北综合征” 可以通过调整呼吸机参数(如提高呼吸机吸入氧体积分数、增加呼吸机呼气末正压等)改善顺行血液的氧合来预防。或者可添加单独的静脉灌注套管,以创建静脉-动脉-静脉 ECMO 回路。
泵血栓形成是一个罕见但往往导致灾难事件的并发症,可能发生在泵头处,导致严重溶血、血流动力学支持失败和死亡。动脉侧回路的任何血栓都可能导致体循环和肺循环的栓塞事件。
推荐意见 9:右上肢脉氧监测有助于早期发现“南北综合征”,调整呼吸机参数改善顺行血流的氧合可预防“南北综合征”。
目前整体而言,ECPR 可以提高 CA 患者的生存率和神经功能预后。针对难治性 OHCA 患者的 ECPR 研究结果显示,ECPR 可提高难治性 OHCA 的生存率 [38-39]。根据 5 个欧洲医学中心的研究数据,在未经选择而使用 ECPR 的 CA 患者中,19% 的患者拥有较好的神经功能预后,而经过特定标准选择后,38% 的 CA 患者可以较好地恢复神经功能 [40]。2015 年明尼苏达复苏中心报道了一项针对 VT/VF 的 OHCA 患者的临床实验。在该实验中,需要将患者从 CA 的发生地点迅速转移至明尼苏达大学,途中持续进行 CPR 并在心脏导管室开始 ECPR,如果冠脉造影提示冠脉复杂病变,需要进行 PCI。这一包括 ECPR 和冠脉造影的程序化策略能够显著提高患者的生存率和神经功能预后,最中 55% 的患者能够存活至出院,50% 的患者能够达到脑功能表现分级(cerebral performance category,CPC) 1~2 级 [26]。
然而,大多数患者会出现多器官功能衰竭,由此延长重症监护病房的住院时间。CA 所致的多种严重疾病可导致 ECPR 患者的住院时间延长。而缺氧性脑损伤是住院期间 ECPR 患者的主要死亡原因。
除了 2018 年《成人体外心肺复苏专家共识》涉及的 ECPR 的预后因素外,有学者使用脑电双频指数来评估预后。Jouffroy 等 [41] 认为 ECPR 患者使用治疗性低温,脑电双频指数小于 30 提示患者在重症监护室住院期间脑死亡的敏感度为 96%,特异度为 82%,阳性预测值为 90%,阴性预测值为 93%,这个结果提示脑电双频指数可以用来评估预后。头颅 CT 也可用于评估 ECPR 患者预后。ECPR 开始 1 h 颅脑 CT 灰白质比能够预测患者预后,平均灰白质比为 1.23,对不良预后的特异度为 100%,基底节灰白质比为 1.24 时对不良预后的特异度为 88%,皮质区灰白质比为 1.22 时对不良预后的特异度为 64% [42]。
ECPR 的预后因素涉及多种指标,这些指标之间的权重及相互作用复杂。Okada 等 [43] 利用日本协会的急救 OHCA 注册系统开发了 TiPS65 评分。该评分纳入 4 个影响预后的因素,分别是年龄 <65 岁,从呼救到到达医院时间≤ 25 min,到达医院时初始心律为可电击心律,以及初始 pH 值,每个因素计 1 分。其评分及存活 1 个月并 CPC 1~2 级概率如表 1 所示。根据该评分系统,对高概率组的 OHCA 患者给予 ECPR 可能是合理的,但极低概率组需重新考虑是否采用 ECPR。由于年龄、从呼救到救治的时间和初始节律通常在到达医院时获得,pH 值也可在到达医院后快速获得,该评分系统可以在患者刚到急诊科立即使用。
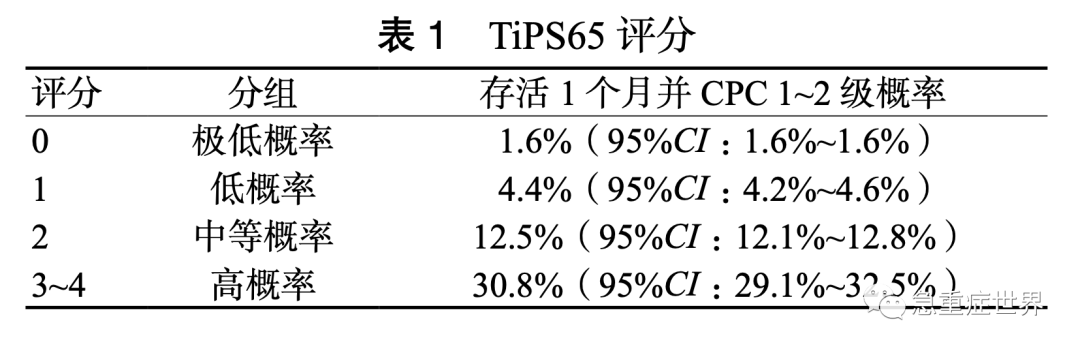
推荐意见 10:整体而言,ECPR 可以一定程度上改善 CA 患者的生存率和神经功能预后; 但影响 ECPR 预后的因素众多,可使用预后模型或多个预后因素对患者进行综合的预后评估。
ECMO 作为一种新的技术治疗方式,为救治心肺功能衰竭的危重患者带来颠覆性的影响。但是因为 ECMO 能够暂时中止维持生命所需的自身心肺功能,因此造成了伦理困境。ECMO 实施必须以一种既尊重生命又尊重死亡, 同时兼顾患者家属情感的方式进行实施与管理 [44]。判断 ECMO 技术是否具有适应性是其临床应用的主要伦理考量之一,因此 ECMO 医务工作者对患者及其直系家属的自主性必须给予充分的尊重,并且提供全面且正确的临床预测与信息 [45]。
本次《成人体外心肺复苏专家共识更新》与 2018 年《成 人体外心肺复苏专家共识》推荐意见的对比及补充见表 2。
综上所述,ECPR 技术迅速发展,适应证越来越广泛,在使用时,要严格排除禁忌证,对于有适应证的患者尽早启动 ECPR,使用过程中严密观察是否出现并发症,准确评估脱机标准,把握撤机时机。ECPR 技术对医护人员技术及团队合作提出了新的要求,相信随着技术的逐步成熟,制约 ECPR 技术发展的瓶颈会被逐渐突破,越来越多的 CA患者可从中获益。

声明:本文来源于中华急诊医学杂志 2023 年 3 月第 32 卷第 3 期,仅用于学习交流,版权归原作者所有。如有侵权违规,请立即联系我们。













