
血管免疫母细胞性 T 细胞淋巴瘤 (AITL)是外周 T 细胞淋巴瘤(PTCL)的一种亚型,具有独特的临床病理和遗传特征。本文通过两个病例分析总结了 AITL 的临床和病理特征,特别强调了 AITL 的准确诊断的独特方面。
病例一
患者是一名71岁女性,全身淋巴结肿大。有风湿性多肌痛病史,曾接受低剂量类固醇治疗 2 年。进行了腋窝淋巴结活检。流式细胞术揭示了一个非典型 T 细胞群,其 CD2、CD4、CD5 和 CD7 呈阳性,表面 CD3 缺失,CD8 呈阴性。45% 的 T 细胞对 CD10 呈阳性。H&E 染色切片显示非典型淋巴细胞的弥漫性浸润,消除淋巴结结构。
存在具有退行性变化的局灶性滤泡。副皮质显示出明显的血管分布,高内皮微静脉显示出树枝状图案。虽然存在一些类似于霍奇金/里德-斯腾伯格 (HRS)细胞的细胞,淋巴细胞的异型性与经典霍奇金淋巴瘤(CHL)的诊断不符。如前所述,流式细胞术表明表型异常,表面 CD3 缺失和 CD10 表达。非典型淋巴细胞对 PD-1 和 ICOS 也呈阳性,证实了 TFH表型。HRS样细胞对 Epstein-Barr 病毒 (EBV)呈阳性,并由非典型 TFH 群体形成玫瑰花。通过聚合酶链反应 (PCR) 对 T 细胞受体基因进行克隆重排,证实了 T 细胞淋巴瘤的诊断。在这种情况下,鉴别诊断将包括具有 TFH 表型的淋巴结 PTCL 与 AITL。在目前的情况下,有两个特征有利于 AITL:包裹非典型淋巴细胞簇的 CD21 树突状细胞的显着扩增和 EBV 阳性 B 细胞的存在。
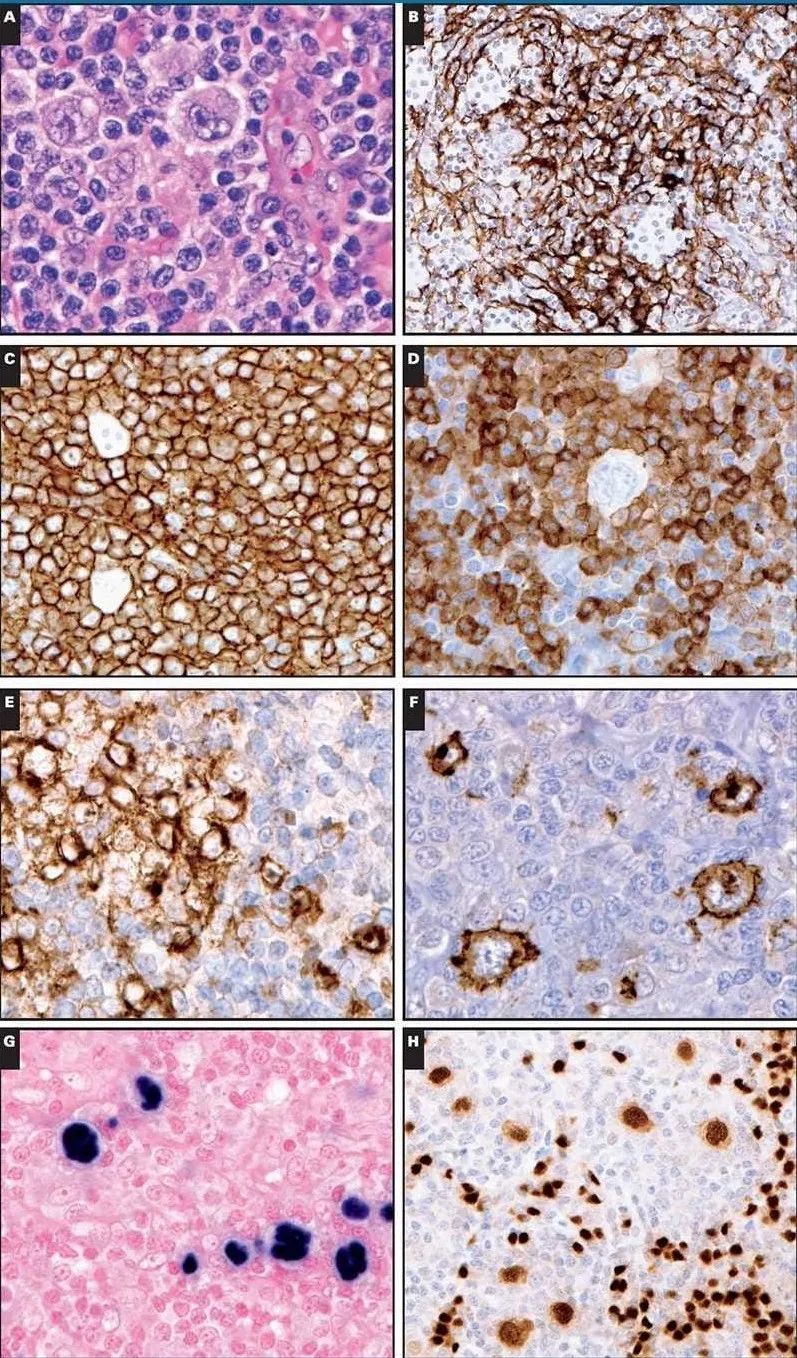
图1:血管免疫母细胞性 T 细胞淋巴瘤伴 Epstein-Barr 病毒 (EBV) 阳性霍奇金/里德-斯腾伯格 (HRS) 样细胞。A,H&E 显示中小淋巴细胞的弥漫性浸润和散在的混合浆细胞。存在突出的高内皮微静脉。存在类似于 HRS 样细胞的分散细胞(×400)。B,CD21 显示扩展的树突状细胞包裹着非典型淋巴细胞簇(×200)。淋巴细胞对 CD4(C,x400)和 CD10(D,x400)呈阳性。CD30 在 HRS 样细胞中呈阳性,(E , x400)其中许多细胞对 CD15 也呈阳性。( F, x400),CD30 染色也突出了非典型淋巴细胞的一个子集。通过 EBER 原位杂交 ( G , x400) 和 PAX5 ( H , x200),HRS 样细胞对 EBV 呈阳性,并表现出形态变化。
病例二
患者是一名 63 岁的女性,有数月的颈部和下颌下淋巴结肿大病史,伴有盗汗和发烧。患者有贫血(血细胞比容,22%;血红蛋白,71 g/L),白细胞计数和血小板正常。她表现出多克隆高丙种球蛋白血症 (85 U/L)和中度升高的乳酸脱氢酶 (LDH)(326 U/L)。检测到 EBV 病毒载量为 420 拷贝/毫升。胸部计算机断层扫描显示双侧胸腔积液和广泛的淋巴结肿大影响腋窝、气管旁和主动脉旁淋巴结,以及肝脾肿大。进行了颈部淋巴结活检。
淋巴结的 H&E 切片图 2 显示了许多带有生发中心的卵泡,显示出星空图案。反应性生发中心似乎缺乏形成良好的套袖,取而代之的是由具有透明细胞质和囊泡核的中等至较大淋巴细胞包围。在滤泡间区域存在混合的浆细胞。在副皮质中观察到血管分布增加。对 CD20、CD79a、CD3、CD4、CD8、CD10、PD1、ICOS、CD21 和 IgD 进行免疫组织化学染色。对 EBV 进行了 Epstein-Barr 病毒编码的小 RNA (EBER)原位杂交。IgD 染色证实没有正常的地幔袖带。相反,生发中心被 PD-1、ICOS 和 CD10 呈阳性的非典型 T 细胞群所包围。非典型 T 细胞对 CD3 和 CD4 呈阳性。CD21 显示滤泡树突状细胞(FDC)网状结构主要局限于滤泡。EBER 在滤泡间区域(10-20/高倍视野)的散在细胞中呈阳性。这些证实了 T 细胞受体 γ 基因的克隆重排模式和多克隆 IG 重排模式。
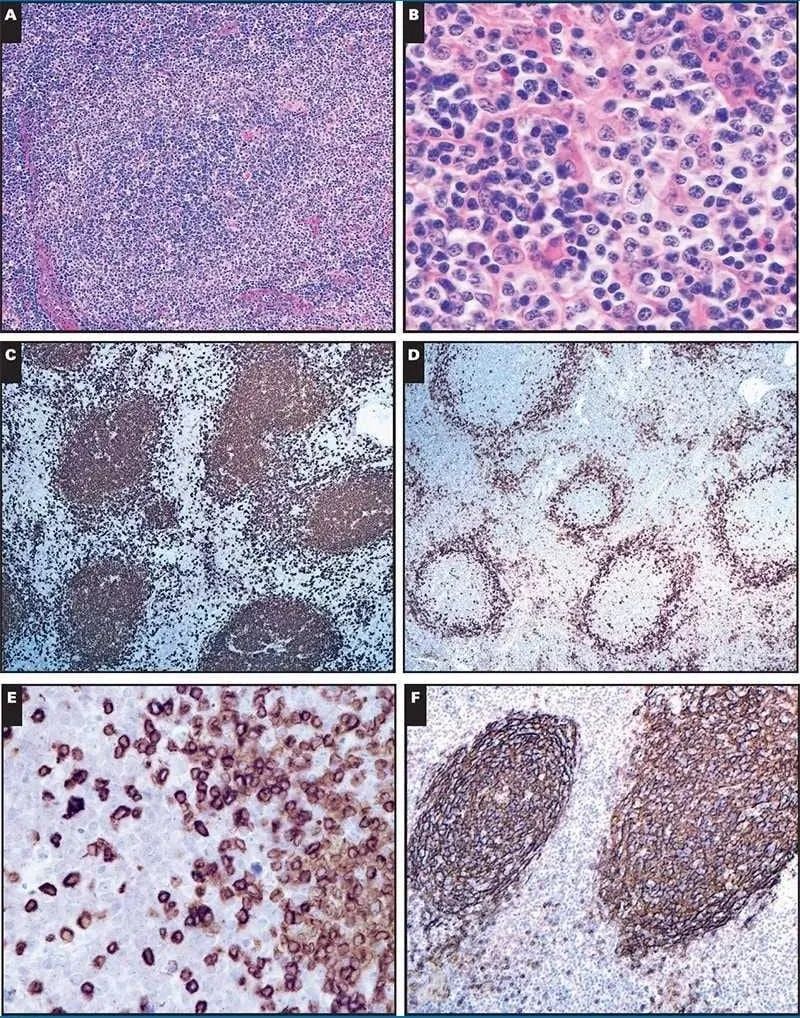
图 2:血管免疫母细胞性 T 细胞淋巴瘤 A,反应性生发中心被具有透明细胞质和免疫母细胞特征的非典型细胞包围。高内皮微静脉围绕非典型滤泡结构(×100)。B、滤泡周细胞胞质透明;存在混合的浆细胞(×400)。C,CD20 突出了生发中心和分散的滤泡间 B 细胞(×40)。D , PD1 在毛囊周围 T 细胞中呈强阳性(×40)。毛囊周围 T 细胞显示 CD3 所见的细胞学异型性。(E, x400)F , CD21 染色显示毛囊内形成良好的毛囊树突状细胞网状结构,但副皮质没有扩张(×400)。
基于这些发现做出了 AITL 模式 Ⅰ 的诊断。AITL 模式Ⅰ可能被误认为非典型滤泡增生。在免疫组织化学染色上很容易看到细胞学异型性。AITL 模式Ⅰ经常缺乏在更高级的情况下看到的 FDC 扩展。已经在连续活检的患者中显示了 AITL 模式Ⅰ到模式Ⅱ到Ⅲ的演变。













