
免疫检查点抑制剂(ICIs)的出现迅速改变了多种癌症的治疗模式,在过去的十年中,从2011年CTLA-4抑制剂在转移性黑色素瘤中的首次批准开始,到目前PD-L1抑制剂已经成为20多种不同癌症适应症治疗的常规手段。本文介绍了2021CSCO指南免疫检查点抑制剂于头颈部鳞癌、晚期食管癌、非小细胞肺癌的数种治疗方案。
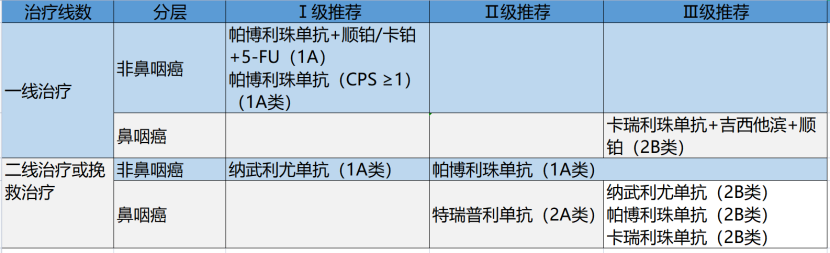
FDA于2019年6月批准帕博利珠单抗联合化疗(铂类和5-FU)作为一线方案治疗复发或转移性头颈部鳞癌,同时批准帕博利珠单抗单药治疗肿瘤细胞表达程序性死亡受体配体-1(PD-L1)(CPS≥1)的患者,并于2016年11月批准纳武利尤单抗作为二线或挽救方案治疗以往经铂类治疗失败的复发或转移性头颈部鳞癌。
2019年10月,MNPA批准纳武利尤单抗用于治疗肿瘤细胞PD-L1表达阳性的此类患者,因此本指南将该药列为Ⅰ级推荐。2016年8月PDA快速批准帕博利珠单抗作为二线或挽救方案治疗以往经铂类治疗失败的复发或头颈部鳞癌。然而在国内,帕博利珠单抗尚未获得二线治疗头颈部鳞癌的适应证,因此指南将该药物列为Ⅱ级推荐。特瑞普利单抗是迄今为止国内乃至全球唯一获批治疗鼻咽癌的免疫检查点抑制剂。
复发或转移性头颈部鳞癌
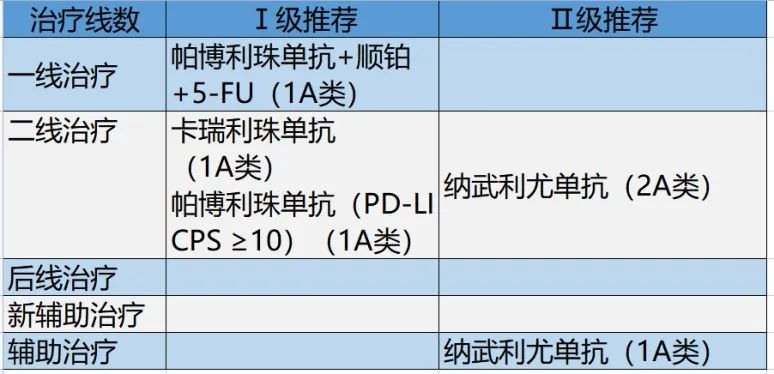
晚期食管癌
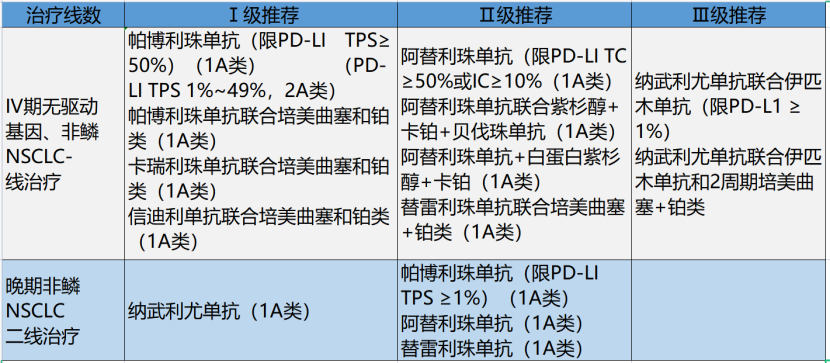
无驱动基因突变的非鳞NSCLC

依据CSCO指南及药物可及性,目前非小细胞肺癌的驱动基因检测EGFR、ALK和ROS1等。
FDA及NMPA批准帕博利珠单抗联合培美曲塞/卡铂(或顺铂)作为EGFR突变和ALK重排检测阴性或未知的Ⅳ期非鳞NSCLC的一线治疗,且不需考虑其PD-L1表达水平,故本指南予以Ⅰ级推荐。
NMPA批准卡瑞利珠单抗联合培美曲塞和卡铂用于EGFR/ALk阴性的不可切除的局部晚期或转移性非鳞NSCLC的一线治疗,且这种联合模式已纳入我国国家医保,因此指南作Ⅰ级推荐。
FDA批准阿替利珠单抗用于PD-L1高表达(TC≥50%或IC≥10%)且EGFR/ALK阴性的Ⅳ期NSCLC患者的一线治疗。目前已在国内上市但由于NMPA尚未批准该适应证,故作Ⅱ级推荐。
FDA批准阿替利珠单抗/贝伐珠单抗/紫杉醇/卡铂联合方案作为EGFR/ALK阴性或未知的Ⅳ期非鳞癌NSCLC的一线治疗,且不需考虑其PD-L1表达水平,阿替利珠单抗目前在国内已上市,但由于NMPA尚未批准该适应证,故作Ⅱ级推荐。
指南Ⅱ级推荐阿替利珠单抗联合白蛋白紫杉醇/卡铂方案用EGFR/ALK阴性或未知的Ⅳ期非鳞癌NSCLC的一线治疗。
NMPA已受理该适应证申请,但目前未获批,故指南Ⅱ级推荐替雷利珠单抗联合培美曲塞/卡铂(或顺铂)作为EGFR突变和ALK重排阴性湖泊未知的非鳞NSCLC的一线治疗。且不需要考虑PD-L1表达水平。
FDA已批准纳武利尤单抗联合伊匹木单抗用于一线治疗PD-L1≥1%且无EGFR及ALK突变的晚期NSCLC,鉴于伊匹木单抗目前在国内未上市,且NMPA尚未批准该适应证,故指南将其作为Ⅲ级推荐。
FDA及EMA先后批准纳武利尤单抗联合伊匹木单抗和两周期化疗作为无EGFR及ALK突变晚期NSCLC的一线治疗。鉴于伊匹木单抗目前在国内未上市,且NMPA尚未批准该适应证,故指南将其作为Ⅲ级推荐。
NMPA已批准纳武利尤单抗用于EGFR/ALK阴性或未知的Ⅳ期NSCLC二线治疗,指南予以Ⅰ级推荐。
FDA批准帕博利珠单抗作为PD-L1表达水平≥1%且EGFR/ALK阴性或未知的Ⅳ期NSCLC二线治疗,由于NMPA尚未批准孩适应证,故指南将其作为基于Ⅱ级推荐。
FDA已批准阿替利珠单抗作为EGFR/ALK阴性或未知的Ⅳ期NSCLC的二线治疗,且不需检测PD-L1的表达水平。阿替利珠单抗国内已上市,但由于NMPA尚未批准该适应证,故将其作为指南的Ⅱ级推荐。
FDA和NMPA均已批准度伐利尤单抗作为不可切除的Ⅲ期NSCLC,同步放化疗后未进展的患者的巩固疗法,故将其作为本指南Ⅰ级推荐。
NSCLC新辅助免疫治疗的Ⅱ期研究已初现曙光:CheckMate 159 和 LCMC3研究分别证实了PD-1单抗纳武利尤单抗和PD-L1单抗阿替利珠单抗作为NSCLC患者的新辅助治疗的可行性和安全性,显著病理学缓解(major pathological response,MPR)率分别达45%和21%。
驱动基因突变阳性的非鳞NSCLC
从目前已有的研究来看,并不支持驱动基因阳性的晚期NSCLC患者一线使用免疫治疗。对于没有接受靶向治疗的EGFR突变阳性的晚期NSCLC患者,及时PD-L1高表达,仍建议将靶向治疗作为一线治疗。
鳞状NSCLC
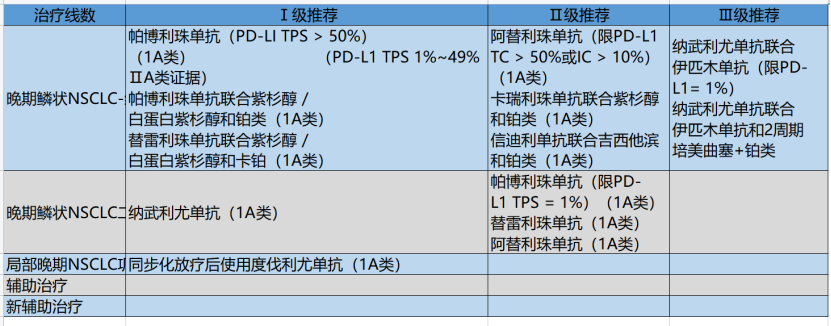
FDA和NMPA已批准帕博利珠单抗用于PD-LI TPS ≥ 50%或≥1%且EGFR/ALK阴性或未知的Ⅳ期NSCLC患者的一线治疗,故指南予以Ⅰ级推荐。
FDA和NMPA均已批准帕博利珠单抗联合卡铂/紫杉醇(或白蛋白紫杉醇)作为Ⅳ期鳞状NSCLC的一线治疗,且不需考虑其PD-L1表达水平,故指南将其作为Ⅰ级推荐。
NMPA已批准替雷利珠单抗联合紫杉醇(或白蛋白紫杉醇)及卡铂用于局部晚期或转移性鳞状NSCLC的一线治疗,且不需要考虑PD-L1表达水平,故指南将其作为Ⅰ级推荐。
FDA批准阿替利珠单抗用于PD-L1高表达(定义为肿瘤细胞PD-L1表达(TC)≥50%或肿瘤浸润免疫细胞PD-L1表达(IC)≥10%)且EGFR/ALK阴性的Ⅳ期NSCLC阴性患者的一线治疗。阿替利珠单抗目前在国内已上市,但由于NMPA尚未批准该适应证,故本指南将其作为Ⅱ级推荐。
NMPA已受理卡瑞利珠单抗联合紫杉醇和卡铂一线治疗局部晚期或转移性鳞状NSCLC的适应证申请,但尚未批准,故指南将其作为Ⅱ级推荐。
NMPA已受理信迪利单抗联合吉西他滨和铂类一线治疗晚期或转移性鳞状NSCLC的适应证申请,但尚未批准,故指南将其作为Ⅱ级推荐。
FDA已批准纳武利尤单抗联合伊匹木单抗用于一线治疗PD-LI ≥1%且无EGFR及ALK突变的晚期NSCLC,鉴于伊匹木单抗目前在国内未上市,且NMPA尚未批准该适应证,故指南将其作为Ⅲ级推荐。
FDA已批准纳武利尤单抗联合伊匹木单抗和两周期化疗用于无EGFR及ALK突变晚期NSCLC的一线治疗鉴于伊匹木单抗目前在国内未上市,且NMPA尚未批准该适应证,故指南将其作为Ⅲ级推荐。
NMPA已批准纳武利尤单抗用于EGFR/ALK阴性或未知的Ⅳ期NSCLC二线治疗,本指南予以Ⅰ级推荐。
NMPA已批准纳武利尤单抗用于EGFR/ALK阴性或未知的Ⅳ期NSCLC二线治疗,本指南予以Ⅰ级推荐。
FDA 已批准帕博利珠单抗作为PD-L1表达水平≥ 1%且EGFR/ALK阴性或未知的Ⅳ期NSCLC二线治疗,由于NMPA尚未批准该适应证,故指南将其作为Ⅱ级推荐。
FDA已批准阿替利珠单抗用于EGFR/ALK阴性或未知的Ⅳ期NSCLC的二线治疗,且不需检测PD-L1的表达水平,阿替利珠单抗国内已上市,但由于NMPA尚未批准该适应证,故指南将其作为Ⅱ级推荐。
本指南Ⅱ级推荐用于EGFR/ALK阴性或未知的Ⅳ期NSCLC的二线治疗。
FDA和NMPA均已批准度伐利尤单抗作为不可切除的Ⅲ期NSCLC,同步放化疗后未进展的患者的巩固疗法,故将其作为本指南Ⅰ级推荐。
-----------END--------------
主要文献:
[1] KATO K, SUN JM, MANISH A, et al. Pembrolizumab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced esophageal cancer: the phase 3 KEYNOTE-590 study. ESMO 2020, LBA 8.
[2] BURTNESS B, HARRINGTON KJ, GREIL R, et al. Pembrolizumnab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squarnous cell carcinoma of the head and neck KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet, 2019; 394 (10212): 1915-1928.
[3] MAZIERES J, DRILON A. LUSQUE A, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: resulis from the IMMUNOTARGET regis-try. Ann Oncol, 2019, 30 (8): 1321-1328.
[4] RECK M, RODRIGUEZ-ABREU D, ROBINSON AG, et al. Pembrolizumab versus chemotherapy for D-L1-positive non-small-cell lung cancer. N Engl J Med, 2016, 375 (19): 1823-1833.
声明:本文由好医术肿瘤学院作者整理,仅供学习,如有侵权请联系删除,转载需授权。













