引用格式
中国抗癌协会淋巴瘤专业委员会, 中国医师协会肿瘤医师分会, 中国医疗保健国际交流促进会肿瘤内科分会. 中国淋巴瘤治疗指南(2021年版)[J]. 中华肿瘤杂志, 2021, 43(7):707-735. DOI:10.3760/cma.j.cn112152-20210516-00382.
中国抗癌协会淋巴瘤专业委员会 中国医师协会肿瘤医师分会 中国医疗保健国际交流促进会肿瘤内科分会
通信作者:石远凯,国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科 抗肿瘤分子靶向药物临床研究北京市重点实验室 100021, Email:syuankai@cicams.ac.cn
【摘要】 淋巴瘤是中国常见的恶性肿瘤之一。2020年中国新发霍奇金淋巴瘤6 829例,死亡2 807例;新发非霍奇金淋巴瘤92 834例,死亡54 351例。淋巴瘤病理类型复杂,异质性强,治疗原则各有不同。近年来,随着人们对淋巴瘤本质认识的不断深入,淋巴瘤在诊断和治疗方面出现了很多新的研究结果,患者生存得到了改善。为了及时反映国内外淋巴瘤治疗领域的进展,进一步提高中国淋巴瘤的规范化诊断和治疗水平,中国抗癌协会淋巴瘤专业委员会、中国医师协会肿瘤医师分会和中国医疗保健国际交流促进会肿瘤内科分会组织专家编写了中国淋巴瘤治疗指南(2021年版)。
【主题词】淋巴瘤;诊断;治疗;指南
基金项目:重大新药创制科技重大专项(2017ZX09304015);中国医学科学院医学与健康科技创新工程(2016-I2M-1-001)
DOI:10.3760/cma.j.cn112152-20210516-00382
淋巴瘤,又称恶性淋巴瘤,是一组起源于淋巴造血系统的恶性肿瘤的总称,是中国常见恶性肿瘤之一。GLOBOCAN 2020数据显示,2020年全球新发霍奇金淋巴瘤(Hodgkin lymphoma, HL)83 087例,其中男性48 981例,女性34 106例;死亡23 376例,其中男性14 288例,女性9 088例。2020年全球新发非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)544 352例,居全部恶性肿瘤新发病例的第13位;其中男性304 151例,居第10位;女性240 201例,居第12位。2020年全球NHL死亡259 793例,居全部恶性肿瘤死亡排名的第12位;其中男性147 217例,居第10位;女性112 576例,居第13位。2020年中国新发HL 6 829例,其中男性4 506例,女性 2 323例;死亡2 807例,其中男性1 865例,女性942例;2020年中国新发NHL 92 834例,其中男性50 125例,女性42 709例;2020年中国NHL死亡54 351例,其中男性29 721例,女性24 630例;男性NHL发病率和死亡率均居全部恶性肿瘤第10位;女性NHL发病率和死亡率均未进入全部恶性肿瘤的前10位。
为规范中国淋巴瘤诊疗行为、提高诊疗水平、改善患者预后、保障医疗质量和医疗安全,国家卫生和计划生育委员会医政医管局委托中国抗癌协会肿瘤临床化疗专业委员会组织专家编写了《中国恶性淋巴瘤诊疗规范(2015年版)》,国家卫生健康委员会医政医管局委托国家癌症中心组织专家编写了《淋巴瘤诊疗规范(2018年版)》。近年来,随着人类对淋巴瘤本质认识的不断深入,淋巴瘤在诊断和治疗等方面出现了很多新的研究结果,患者生存得到了改善。淋巴瘤是一类以药物治疗为主的疾病,在过去15年中,中国抗淋巴瘤新药临床试验取得了长足发展,中国淋巴瘤患者有了更多的治疗选择。为了及时反映国内外淋巴瘤治疗领域的进展,进一步提高中国淋巴瘤的规范化诊断和治疗水平,中国抗癌协会淋巴瘤专业委员会、中国医师协会肿瘤医师分会和中国医疗保健国际交流促进会肿瘤内科分会组织专家编写了《中国淋巴瘤治疗指南(2021年版)》。
一、诊断
淋巴瘤的诊断主要依靠临床表现、实验室检查、影像学检查、组织病理学和分子病理学检查。组织病理学和分子病理学诊断是决定治疗原则和判断预后的重要依据,是淋巴瘤诊断的金标准。
(一)临床表现
淋巴瘤可表现为局部症状和全身症状。绝大多数HL患者以浅表淋巴结肿大为首发症状。NHL患者大部分以浅表淋巴结肿大为首发症状,部分患者原发于结外淋巴组织或器官。淋巴瘤常见的全身症状有发热、盗汗、体重减轻、皮肤瘙痒和乏力等。以下3种情况中出现任何1种即可诊断为B症状:(1)不明原因发热>38℃,连续3 d以上,排除感染的原因;(2)夜间盗汗(可浸透衣物);(3)体重于诊断前半年内下降>10%。
(二)体格检查
体格检查时应注意浅表淋巴结、扁桃体、肝脾的检查以及有无骨骼压痛。淋巴瘤患者的肿大淋巴结多数无痛、表面光滑、质韧饱满,早期大小不等、孤立或散在,后期互相融合、与皮肤粘连、固定或破溃。
(三)辅助检查
1. 实验室检查:患者在治疗前应行血常规、生化常规[包括肝肾功能、乳酸脱氢酶(lactate dehydrogenase, LDH)、碱性磷酸酶、β2-微球蛋白、电解质等]、感染筛查[乙型肝炎病毒、丙型肝炎病毒(hepatitis virus C, HCV)、人类免疫缺陷病毒(human immunodeficiency virus, HIV)和梅毒,异常者需行病毒载量或确诊实验]、血沉、免疫球蛋白、EB病毒(Epstein-Barr virus, EBV)、巨细胞病毒和骨髓检查等,若存在中枢神经系统(central nervous system, CNS)受侵危险因素,需行腰椎穿刺行脑脊液常规、脑脊液生化、脑脊液细胞学和墨汁染色检查。对于胃淋巴瘤,应行幽门螺旋杆菌(helicobacter pylori, Hp)检查;对于NK/T细胞淋巴瘤和其他EBV相关淋巴瘤,应行外周血EBV DNA定量检测。
2. 影像学及其他辅助检查:影像学检查包括CT、磁共振成像(magnetic resonance imaging, MRI)、正电子发射计算机断层扫描(positron emission tomography/computed tomography, PET-CT)和超声等。其他辅助检查包括心电图、内窥镜和肺功能等。高龄、有心血管系统基础疾病或拟使用蒽环类药物治疗的患者需行超声心动检查;拟使用博来霉素或既往存在肺基础疾病者应行肺功能检查;病理诊断为NK/T细胞淋巴瘤、套细胞淋巴瘤(mantle cell lymphoma, MCL)等胃肠道高受侵风险者和可疑胃肠道受侵的淋巴瘤患者应行相应的内窥镜检查。采用PET-CT评估疗效时,PET-CT检查结果可能因炎症而出现假阳性,故若出现无法解释的PET-CT阳性病变时,应根据具体情况追加其他检查。
3. 病理检查:病理检查是淋巴瘤确诊和分型的金标准。活检时,应注意以下几点:(1)淋巴结活检应选择增长迅速、饱满、质韧的肿大淋巴结,尽量完整切除,避免细针穿刺细胞学检查。(2)尽量选择受炎症干扰较小部位的淋巴结进行活检。如有多个解剖区域的淋巴结病灶,一般宜选择颈部、锁骨上和腋窝淋巴结。(3)术中应避免挤压组织,切取的组织应尽快固定。(4)病理检查应包括形态学、免疫组织化学(immunohistochemistry, IHC)、荧光原位杂交(fluorescence in situ hybridization, FISH)、淋巴细胞抗原受体基因重排和其他分子病理学检测。
二、分期
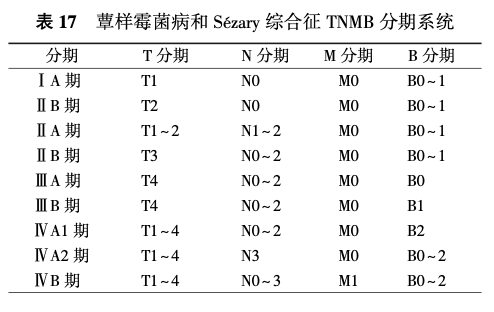
淋巴瘤的临床分期依据疾病侵犯部位以及有无B症状,目前采用的是Ann Arbor-Cotswolds分期系统(表1),同时根据患者的全身症状分为A组(无B症状)和B组(有B症状)。2014版Lugano分期标准对Ann Arbor-Cotswolds分期进行了改良(表2)。某些特殊部位的淋巴瘤采用特定的分期系统,如原发胃肠道淋巴瘤采用Lugano分期系统(表3)。此外,慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)采用Binet分期或Rai分期,皮肤蕈样霉菌病和Sézary综合征采用欧洲癌症治疗研究组织(the European Organization for Reasearch and Treatment of Cancer, EORTC)的TNMB分期,其他原发皮肤淋巴瘤采用EORTC的TNM分期标准。

三、疗效评价
目前主要采用Lugano 2014评价标准评价淋巴瘤的治疗效果(表4),治疗效果分为基于CT和(或)MRI评价的影像学缓解和基于PET-CT评价的代谢缓解,PET-CT评价代谢缓解的依据是PET 5分法(Deauville 标准)(表5)。2017国际工作组共识认为淋巴瘤疗效评价标准(RECIL 2017)是新建立的疗效评价标准,正在逐渐得到应用。
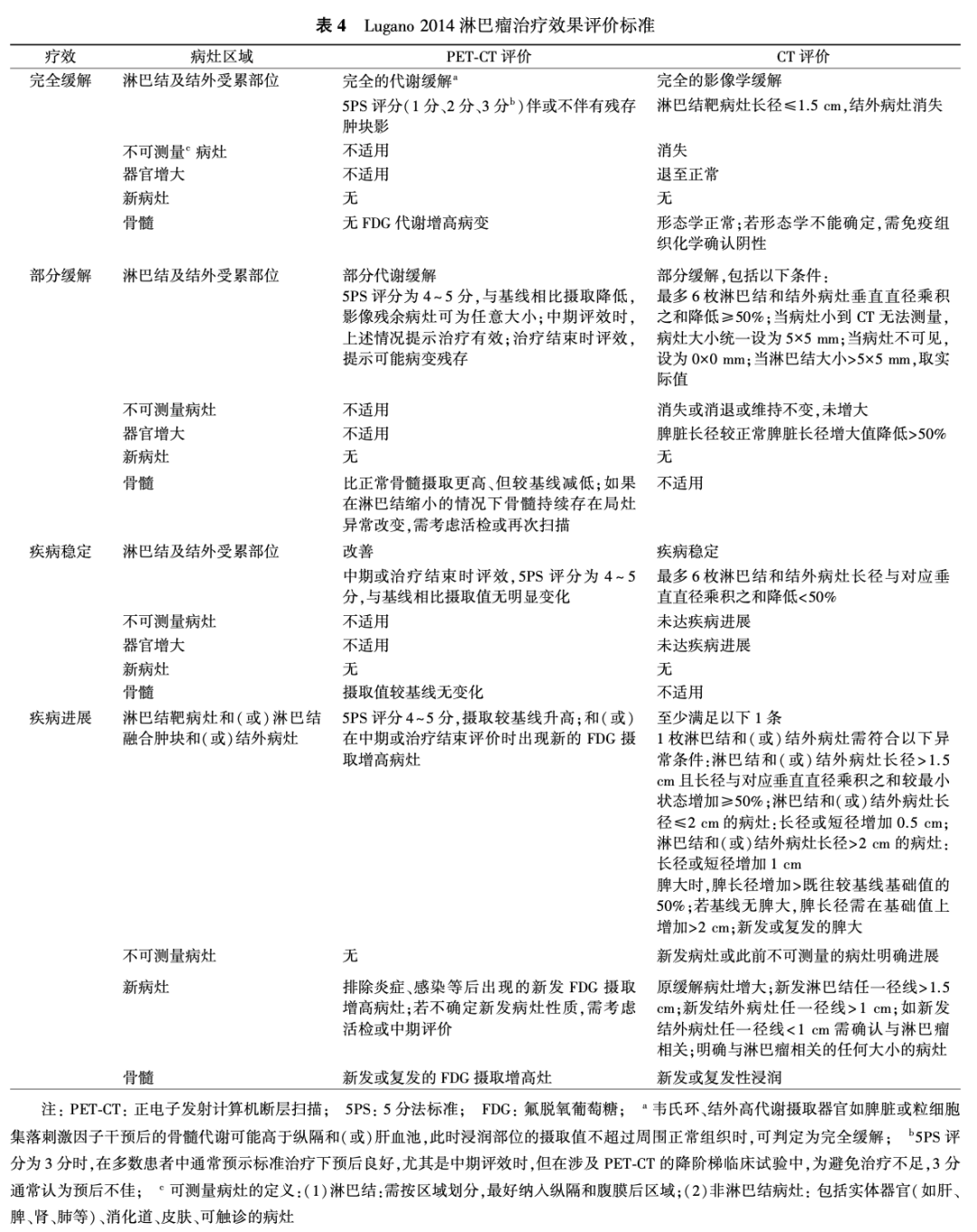


四、病理分类
淋巴瘤的病理分类复杂。随着免疫学、分子生物学及临床研究进展,1994年国际淋巴瘤研究组基于大量研究进展,提出了修订的欧美淋巴瘤分类(Revised European-American Lymphoma Classification,REAL),简称REAL分类。REAL分类方法认为,每一种病理类型的淋巴瘤均具有独特的组织形态、免疫表型、基因特征、临床表现及预后。因此,每一种病理类型的淋巴瘤均为独立的疾病,这将有助于制定个体化治疗方案和判断预后。REAL分类囊括了整个淋巴造血系统恶性肿瘤,包括HL、NHL和淋巴细胞白血病,并将NHL分为T/NK细胞来源和B细胞来源。在REAL分类的基础上,2001年世界卫生组织(World Health Organization, WHO)提出了造血和淋巴组织肿瘤分类方案,得到广泛应用和认可,WHO造血和淋巴组织肿瘤分类淋巴瘤部分(2017年修订版)见表6。
五、淋巴瘤常见病理类型的诊断与治疗
(一)HL
HL发病率占淋巴瘤的5%~10%,男性多于女性。欧美发达国家HL的发病年龄呈典型的双峰分布,分别为20~30岁和50~70岁;我国HL发病年龄较早,中位发病年龄为30岁左右。HL病因不详,部分与EBV感染有关。HL分为结节性淋巴细胞为主型霍奇金淋巴瘤(nodular lymphocyte predominant Hodgkin lymphoma, NLPHL)和经典型霍奇金淋巴瘤(classic Hodgkin lymphoma,cHL)。cHL约占HL的90%,可分为4种组织学亚型,即结节硬化型、富于淋巴细胞型、混合细胞型和淋巴细胞消减型。
1. 临床表现
90%的HL以淋巴结肿大为首发症状,颈部淋巴结是最常见的受累部位,多表现为质韧无痛淋巴结肿大。纵隔淋巴结也是常见受累部位,大部分患者以淋巴结肿大压迫引起的症状就诊。随着病情进展可逐渐扩散到其他淋巴结区域,但较少出现淋巴结跳跃性受侵。HL可累及脾、肝、骨等,部分患者可伴有B症状、乏力、皮肤瘙痒等症状,血沉升高、贫血、白蛋白降低、血清LDH升高多见于肿瘤负荷较大、肿瘤生长速度较快的患者。
2. 病理诊断
HL有独特的病理特征,在炎症细胞和反应性细胞所构成的微环境中散在分布少量Reed-Sternberg(R-S)细胞及变异型R-S细胞。典型R-S细胞为双核或多核巨细胞,核仁嗜酸性,大而明显,细胞质丰富;若细胞表现为对称的双核时则称为镜影细胞。NLPHL中典型R-S细胞少见,肿瘤细胞因细胞核大、折叠,似爆米花样,故又称为爆米花细胞或淋巴细胞性和(或)组织细胞性R-S细胞变型细胞。诊断HL应常规检测的IHC标志物包括CD45(LCA)、CD20、CD15、CD30、PAX5、CD3、MUM1、Ki-67和EBV-EBER。cHL常表现为CD30(+)、CD15(+/-)、PAX5(弱+)、MUM1(+)、CD45(-)、CD20(-/弱+)、CD3(-)、BOB1(-)、OCT2(-/+)、部分患者EBV-EBER(+)。NLPHL常表现为CD20(+)、CD79ɑ(+)、BCL6(+)、CD45(+)、CD3(-)、CD15(-)、CD30(-)、BOB1(+)、OCT2(+)、EBV-EBER(-)。在进行鉴别诊断时需增加相应的标志物检查,以鉴别间变性大细胞淋巴瘤(anaplastic large cell lymphoma, ALCL)或弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)等。
3. 治疗
(1)一线治疗
①NLPHL的一线治疗
NLPHLⅠ~Ⅱ期病变多见,大肿块、纵隔淋巴结受累及B症状少见。>90%的Ⅰ~Ⅱ期NLPHL患者可长期生存。相较于Ⅰ~Ⅱ期NLPHL,Ⅲ~Ⅳ期患者预后较差,在治疗前可考虑对适当部位进行活检,以排除是否有大细胞转化。Ⅲ~Ⅳ期NLPHL采用化疗±利妥昔单抗为主的综合治疗。
(a)无大肿块的ⅠA或ⅡA期NLPHL:对于无大肿块的ⅠA期、ⅡA期且受侵淋巴结区域位置接临的NLPHL,推荐受累部位放疗(involved site radiotherapy, ISRT);对于孤立淋巴结病变经完整手术切除后的ⅠA期患者,可以选择观察;NLPHL行单纯化疗的相关数据较少,除了参加临床试验,不推荐对此类NLPHL患者行单纯化疗;使用利妥昔单抗单药治疗复发率高,不推荐单独使用。
(b)ⅠA或ⅡA期伴大肿块,ⅠB或ⅡB期,或病灶相距较远的ⅡA期NLPHL:推荐短程化疗+利妥昔单抗+IRST,化疗方案可参考cHL的治疗方案。
(c)Ⅲ~Ⅳ期NLPHL:Ⅲ~Ⅳ期NLPHL可选择化疗+利妥昔单抗±ISRT,化疗方案参考cHL的治疗方案,也可选择利妥昔单抗单药治疗。对于有症状的局部病灶可选择姑息性放疗;若患者无任何症状,也可以选择观察。
②cHL的一线治疗
国际权威研究机构对早期cHL的不良预后因素进行了整理(表7),不同研究机构对于早期和晚期cHL的定义有所不同(表8)。对于早期cHL,推荐化放疗综合治疗,单纯化疗的局部复发率高,但化放疗综合治疗与单纯化疗患者的总生存时间(overall survival, OS)相似。晚期cHL采用化疗为主的综合治疗。

(a)早期cHL:在无PET-CT指导治疗的时代,早期预后良好cHL的标准治疗为2个周期ABVD方案(多柔比星+博来霉素+长春花碱+达卡巴嗪)化疗+20 Gy放疗,早期预后不良型cHL推荐4个周期ABVD方案化疗+30 Gy放疗。为降低长期生存患者的远期不良反应,多项前瞻性临床研究评价了2~3个周期化疗后PET-CT阴性患者是否可以不行放疗,即早期预后良好型患者仅接受3~4个周期ABVD方案化疗,早期预后不良型患者仅接受6个周期ABVD方案化疗,结果显示,未放疗患者的局部复发率升高,尤其是早期预后良好型患者,但单纯化疗组与化放疗联合治疗组的OS相似。H10研究结果显示,早期PET-CT阳性的患者更换为高强度方案化疗后可改善不良预后。
(b)晚期cHL:推荐6~8个周期ABVD方案化疗,对残留病变给予放疗。剂量增强的BEACOPP方案(博来霉素+依托泊苷+多柔比星+环磷酰胺+长春新碱+丙卡巴肼+泼尼松)可提高<60岁患者的生存,但骨髓抑制、生殖不良反应和第二原发肿瘤累积发生率增加。接受2个周期ABVD方案化疗后PET-CT阴性的患者可继续接受ABVD方案或AVD方案(多柔比星+长春花碱+达卡巴嗪)化疗;PET-CT阳性的患者后续需要选择高强度方案化疗。在中期PET-CT指导治疗的临床研究中,无论患者一线接受ABVD方案还是BEACOPP方案,约80%的患者2个周期化疗后可达PET-CT阴性,因此,PET-CT指导下的晚期cHL的治疗策略可降低预后良好型患者的化疗强度,并且可以提早发现预后不佳的患者,通过更改治疗方案改善其不良预后。另外,基于ECHELON-1研究结果,美国食品药品监督管理局(Food and Drug Administration, FDA)于2018年3月21日批准维布妥昔单抗+AVD方案用于CD30阳性Ⅳ期HL成人患者的一线治疗。
(2)复发或难治性患者的治疗
复发或难治性HL接受二线解救方案治疗,疗效达完全缓解(complete response, CR)或部分缓解(partial response, PR)的患者可行自体造血干细胞移植(autologous hematopoietic stem cell transplantation, ASCT),对于初治时未曾放疗的部位,也可放疗。
对于复发或难治性HL患者,应根据复发肿瘤情况和患者身体状况以及一线治疗方案选择二线化疗方案。对于一线治疗时未曾接受过化疗者,一线化疗方案可取得满意的疗效。二线化疗及二线以后的化疗方案包括DHAP方案(地塞米松+顺铂+阿糖胞苷)、ESHAP方案(依托泊苷+甲基强的松龙+高剂量阿糖胞苷+顺铂)、GDP方案(吉西他滨+顺铂+地塞米松)、GVD方案(吉西他滨+长春瑞滨+脂质体阿霉素)、ICE方案(异环磷酰胺+卡铂+依托泊苷)、IGEV方案(异环磷酰胺+吉西他滨+依托泊苷+泼尼松)、BeGEV方案(苯达莫司汀+吉西他滨+长春瑞滨)和MINE方案(依托泊苷+异环磷酰胺+美司钠+米托蒽醌)等。FDA于2011年8月17日批准维布妥昔单抗用于治疗ASCT治疗失败的HL或至少应用2种以上化疗方案且不适合ASCT的HL患者。国家药品监督管理局(National Medical Products Administration, NMPA)于2020年5月14日批准维布妥昔单抗用于治疗复发或难治性CD30阳性的HL或ALCL。基于CheckMate-205研究结果,FDA于2016年5月17日批准纳武利尤单抗用于治疗ASCT和维布妥昔单抗治疗后复发或难治性cHL。基于KEYNOTE-087研究结果,FDA于2017年3月14日批准帕博利珠单抗用于复发或难治性cHL的治疗。基于3项关键性注册临床试验,NMPA分别于2018年12月27日、2019年5月29日和2019年12月27日批准信迪利单抗、卡瑞利珠单抗和替雷利珠单抗上市,用于治疗二线系统化疗后复发或难治性cHL。
4. 预后因素和生存
(1)早期HL的不良预后因素见表7,不同研究机构定义的不良预后因素略有差别。

(2)晚期HL最常用的预后评价系统为国际预后评分,包括7个不良因素,分别为:①白蛋白<40 g/L;②血红蛋白<105 g/L;③男性;④年龄≥45岁;⑤Ⅳ期病变;⑥白细胞增多,白细胞计数≥15×109/L;⑦淋巴细胞减少,占白细胞比例<8%和(或)淋巴细胞计数<0.6×109/L,每增加1个不良因素,复发风险增加7%~8%。
(3)中期PET-CT检查:2~3个周期化疗后PET-CT检查为阴性的患者预后明显优于PET-CT阳性的患者。
(4)中国早期cHL患者无失败生存率和5年生存率分别为90.1%和96.7%,晚期cHL患者5年无失败生存率和5年生存率分别为78.8%和86.0%。
(二)DLBCL
DLBCL是所有NHL中最常见的类型,在西方国家约占成人NHL的30%,在中国约占成人NHL的40%,中位发病年龄为50~70岁,男性略高于女性。
1. 病理诊断及分类
诊断DLBCL常规IHC标志物包括CD19、CD20、PAX5、CD3、CD5、CD79α、CyclinD1、Ki-67;通常表现为CD19(+)、CD20(+)、PAX5(+)、CD3(-);对具体亚型的诊断应遵循WHO造血和淋巴组织肿瘤分类淋巴瘤部分(2017年修订版)。根据细胞起源的不同将DLBCL分为3类,即生发中心B细胞样(germinal center B-cell like, GCB)型、活化B细胞样型和第3型。临床上通常采用Han′s分型进行分类,分为GCB型及非生发中心B细胞样(non-germinal center B-cell like, non-GCB)型,其中GCB型的IHC表现为:(1)CD10(+)、不论BCL-6和MUM1表达如何;(2)CD10(-)、BCL-6(+)、MUM1(-)。其他情况均为non-GCB型。明确诊断及分期后,应行FISH检测BCL-2、BCL-6、MYC基因重排,还应行IHC检测以明确BCL-2、BCL-6、MYC的表达情况,这将有助于判断患者预后并选择治疗方案。高级别B细胞淋巴瘤伴MYC和BCL-2和(或)BCL-6基因易位,其遗传学特征为同时存在MYC和BCL-2或BCL-6基因重排(双打击),或同时存在MYC、BCL-2和BCL-6基因重排(三打击);双表达DLBCL指MYC和BCL-2的IHC表达阳性(MYC蛋白表达>40%,BCL-2蛋白表达>50%);两者均提示预后不良。
2. 预后指标
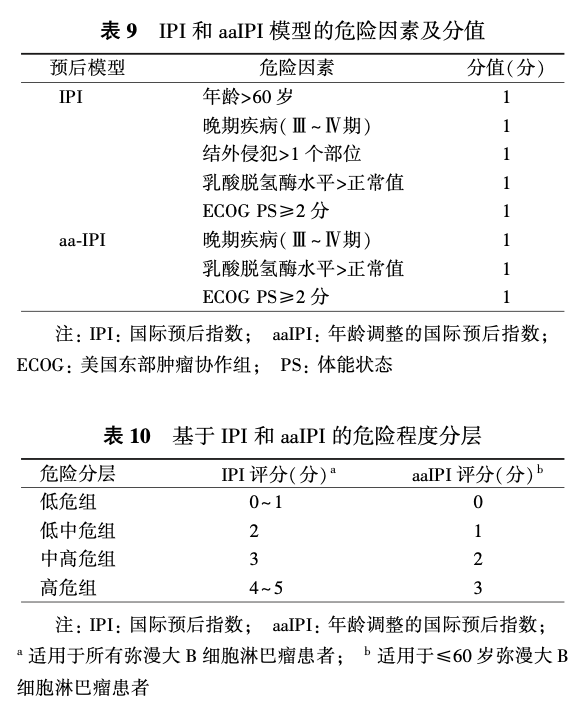
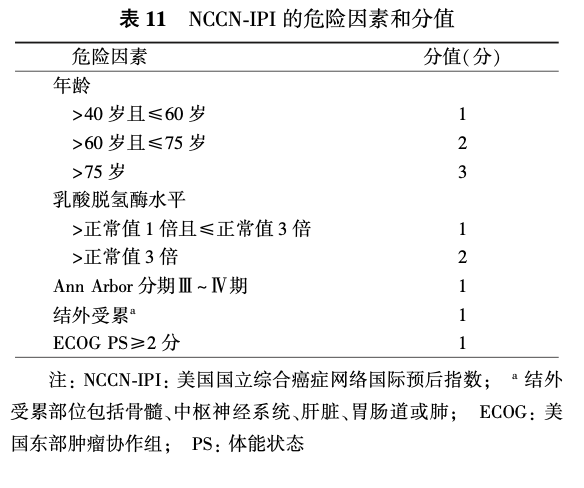
国际预后指数(international prognostic index,IPI)是DLBCL患者预后的经典评价系统,年龄调整的IPI(age adjusted IPI, aaIPI)适合≤60岁的患者。IPI和aaIPI中的每个危险因素计为1分(表9、10)。利妥昔单抗时代形成的修正的IPI(revised international prognostic index, R-IPI)被认为能够更好地预测患者预后,其危险因素包括年龄>60岁、晚期疾病(Ⅲ~Ⅳ期)、结外侵犯>1个部位、LDH水平>正常值和美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态(performance status, PS)≥2分,每个危险因素均为1分,R-IPI 0分为预后非常好组;R-IPI 1~2分为预后好组;R-IPI 3~5分为预后差组。另外,在IPI基础上将年龄和LDH进一步分层形成的NCCN-IPI,能更准确地预测患者预后[低危组(0~1分),低中危组(2~3分),中高危组(4~5分),高危组(≥6分)](表11)。
3. 治疗
DLBCL的治疗模式是以内科治疗为主的综合治疗。内科治疗包括化疗、靶向治疗和免疫治疗,应综合考虑患者年龄、临床分期、病理类型、分子遗传学特征和IPI评分来制定治疗方案。
(1)一线治疗
DLBCL的初始治疗应根据患者的年龄、身体状况、临床分期、病理类型、分子遗传学特征等采取个体化治疗策略。如果有合适的临床试验,则建议患者参加。对于肿瘤负荷较高的患者,建议采取预防措施,如在正式治疗开始前给予泼尼松±长春新碱作为前期治疗,以避免发生肿瘤溶解综合征。此外,应尽量避免由于骨髓抑制引起的治疗药物剂量减低。对于以治愈为目的或年龄>60岁的患者可以预防性应用重组人粒细胞集落刺激因子以尽可能避免发热性中性粒细胞减少症的发生。聚乙二醇化重组人粒细胞集落刺激因子每个化疗周期仅需应用1次就可以有效预防化疗导致的中性粒细胞减少症的发生。
①Ⅰ~Ⅱ期DLBCL的一线治疗:对于Ⅰ~Ⅱ期无大肿块(肿块最大径<7.5 cm)的DLBCL患者,若IPI评分为0分,可选择4个周期R-CHOP方案(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松)序贯2个周期利妥昔单抗治疗,或4~6个周期R-CHOP-14方案±ISRT;对于IPI评分≥1分的DLBCL患者,可选择3个周期R-CHOP方案+ISRT,或6个周期R-CHOP方案±ISRT。对于Ⅰ~Ⅱ期DLBCL伴有大肿块(肿块最大径≥7.5 cm)的DLBCL患者,可选择6个周期R-CHOP方案±ISRT。
②Ⅲ~Ⅳ期DLBCL的一线治疗:对于Ⅲ~Ⅳ期DLBCL患者推荐R-CHOP方案治疗,如有合适的临床试验,建议患者参加。R-CHOP方案治疗2~4个周期后全面复查以重新分期并确认疗效,如果治疗无效,建议再次活检,并参考复发或难治性DLBCL的治疗方案;如果治疗有效(疗效评价为CR或PR),则继续R-CHOP方案化疗至6个周期。
③特殊类型DLBCL的一线治疗:对于体力状况较差或年龄>80岁的Ⅰ~Ⅱ期DLBCL患者,可选择R-mini-CHOP方案[利妥昔单抗+减低剂量的CHOP方案(剂量减低为标准剂量的1/2~1/3)]或R-CEPP方案(利妥昔单抗+环磷酰胺+依托泊苷+强的松+丙卡巴嗪)、R-CDOP方案(利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松)或R-GCVP方案(利妥昔单抗+吉西他滨+环磷酰胺+长春新碱+泼尼松)等治疗。体力状态欠佳且肿瘤负荷高的DLBCL患者,可以在化疗开始前给予低剂量的诱导治疗,药物包括泼尼松±长春新碱,以预防肿瘤溶解综合征的发生。乙型肝炎病毒感染者应密切监测外周血乙型肝炎病毒DNA含量,并给予抗乙型肝炎病毒治疗。左心室功能不全的患者初始治疗可选择DA-EPOCH-R方案(剂量调整的依托泊苷+强的松+长春新碱+环磷酰胺+表柔霉素)、R-CDOP方案、R-CEPP方案、R-CEOP方案(利妥昔单抗+环磷酰胺+依托泊苷+长春新碱+强的松)或R-GCVP方案。对于伴有CNS受侵的DLBCL患者,若为脑实质受侵,需加用静脉高剂量甲氨蝶呤(≥3 g/m2,静脉滴注);若为脑膜受侵,需鞘内注射甲氨蝶呤或阿糖胞苷;也可在R-CHOP方案化疗的基础上加用3~3.5 g/m2的甲氨蝶呤(静脉滴注),或在R-CHOP+甲氨蝶呤或阿糖胞苷鞘内注射后采用静脉滴注甲氨蝶呤作为巩固治疗。对于CNS受侵风险高的DLBCL患者,如CNS-IPI高危[伴有4~6个CNS受侵的危险因素:年龄>60岁、LDH升高、Ⅲ~Ⅳ期、ECOG PS>1分、结外病变>1个、肾或肾上腺受累]、HIV相关淋巴瘤、伴MYC、BCL2和(或)BCL6重排的高级别B细胞淋巴瘤、原发睾丸DLBCL、原发皮肤DLBCL腿型、ⅠE期乳腺DLBCL等,应进行CNS预防治疗。预防治疗的方法存在争议,可在全身治疗中或治疗后采用鞘内注射4~8次甲氨蝶呤或阿糖胞苷,或在全身治疗过程中或一线治疗结束后静脉滴注3~3.5 g/m2甲氨蝶呤2~4个周期进行预防性治疗。
原发睾丸DLBCL患者,即使分期为Ⅰ期,CNS和对侧睾丸复发风险也同样较高,因此,对于原发睾丸DLBCL患者,在完成一线治疗后,推荐使用甲氨蝶呤以及对侧睾丸放疗(25~30 Gy)分别预防CNS和对侧睾丸复发。原发纵隔大B细胞淋巴瘤的最佳一线治疗尚存在争议,可选择的治疗方案包括DA-EPOCH-R方案、R-CHOP方案±ISRT或R-CHOP方案续贯R-ICE方案(利妥昔单抗+异环磷酰胺+卡铂+依托泊苷)±ISRT等。治疗后残余纵隔肿块常见,推荐化疗结束时采用PET-CT进行评估。伴MYC、BCL2和(或)BCL6重排的高级别B细胞淋巴瘤常伴有不良预后指标,如LDH增高、骨髓受侵、CNS受侵和高IPI评分等。高级别B细胞淋巴瘤无推荐的标准一线治疗方案,首选推荐参加合适的临床试验,也可采用强化治疗方案,如DA-EPOCH-R方案、R-HyperCVAD方案(利妥昔单抗+环磷酰胺+长春新碱+阿霉素+地塞米松与利妥昔单抗+高剂量甲氨蝶呤+阿糖胞苷交替使用)和R-CODOX-M/R-IVAC方案(利妥昔单抗+环磷酰胺+长春新碱+多柔比星联合甲氨蝶呤与异环磷酰胺+依托泊苷+阿糖胞苷交替使用)方案,但是需要考虑药物不良反应,评估患者的体能评分和合并症。高级别B细胞淋巴瘤患者CNS复发和受侵风险较高,推荐进行CNS预防性治疗。原发CNS的DLBCL患者推荐利妥昔单抗+高剂量甲氨蝶呤(≥3.5 g/m2)为基础的联合方案治疗,可以联合利妥昔单抗+高剂量阿糖胞苷+替莫唑胺等,不能耐受高剂量甲氨蝶呤的患者可选用其他方案化疗。对于化疗达CR的年轻患者,进行减量的全脑放疗或ASCT,老年患者可不行全脑放疗;未达CR的患者则行高剂量阿糖胞苷±依托泊苷、全脑放疗或最佳支持治疗。
(2)复发或难治性患者的治疗
复发或难治性DLBCL根据是否符合移植条件进行分层治疗,可选择其他与CHOP无交叉耐药的药物或个体化治疗方案。如果患者具备移植条件且达到了CR或PR,则行造血干细胞移植;如果患者不具备移植条件或治疗后仍为疾病稳定(stable disease, SD)或疾病进展(progressive disease, PD),则行最佳支持治疗。在任何情况下,如果条件允许,推荐进入临床试验。
①符合移植条件的DLBCL患者:如果患者符合移植条件,则先进行二线治疗,方案包括DHAP±R(利妥昔单抗)方案、DHAX(地塞米松+阿糖胞苷+奥沙利铂)±R方案、GDP±R方案、ICE±R方案、ESHAP±R方案、GemOx(吉西他滨+奥沙利铂)±R方案、MINE±R方案等。若达CR,可选择ASCT±ISRT或参加合适的临床试验,如果患者有接受异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-SCT)的适应证,可行allo-SCT。若为PR,则可选择抗CD-19嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T)治疗,或ASCT±ISRT,或参加临床试验,如果患者有接受allo-SCT的适应证,可行allo-SCT。若为SD或PD,则可选择抗CD-19 CAR-T治疗,或参加合适的临床试验,或选择替代的其他治疗方案,或姑息性ISRT,或最佳支持治疗。基于ZUMA-1研究和JULIET研究,美国FDA分别于2017年10月20日和2018年5月1日批准了Axicabtagene Ciloleucel(Yescarta)和Tisagenlecleucel(Kymriah)用于治疗至少接受过二线治疗的复发或难治性DLBCL、转化型滤泡性淋巴瘤和高级别B细胞淋巴瘤。基于TRANSCEND研究,FDA于2021年3月26日批准了Lisocabtagene Maraleucel(Juno Therapeutics)用于治疗至少接受过二线治疗的复发或难治性大B细胞淋巴瘤(包括DLBCL和惰性淋巴瘤转化的DLBCL)。NMPA于2021年6月22日批准益基利仑赛注射液(又称阿基仑赛,代号:FKC876)上市,用于二线或以上系统治疗后复发或难治性DLBCL成人患者。
②不符合移植条件的DLBCL患者:若患者不符合移植条件,则可选择参加合适的临床试验,或二线治疗,或姑息性ISRT,或最佳支持治疗。不符合移植条件的患者经过治疗后疗效评价如为CR,进入临床随访期;如疗效为PR、SD或PD,且既往未使用过CD-19 CAR-T治疗,可选择抗CD-19 CAR-T治疗,或参加临床试验,或选择替代的其他治疗方案,或姑息性ISRT,或最佳支持治疗。二线治疗方案包括GemOx±R方案、CEPP±R方案、CEOP(环磷酰胺+依托泊苷+长春新碱+强的松)±R方案、DA-EPOCH±R方案、GDP±R方案、吉西他滨+长春瑞滨±R方案、利妥昔单抗方案。特殊情况下可选择的治疗包括:维布妥昔单抗(适用于CD30阳性的DLBCL)、苯达莫司汀±利妥昔单抗、伊布替尼(适用于non-GCB型DLBCL),来那度胺±利妥昔单抗(适用于non-GCB型DLBCL)等。另外,基于GO29365研究,Polatuzumab Vedotin于2019年6月10日获FDA批准上市,适应证为与苯达莫司汀和利妥昔单抗联合治疗至少接受过2次治疗的复发性或难治性DLBCL成人患者。但Polatuzumab Vedotin目前尚未在中国上市
4. DLBCL患者的随访
若患者治疗结束后疗效评价为CR,则进入随访阶段,此后2年内每3个月复查1次,第3~5年每6个月复查1次,5年后每年复查1次,终身随访。当临床出现可疑复发征象时应立即检查,对于新出现的病灶应尽量进行活检,明确病理诊断。
为了解决利妥昔单抗的可及性问题,近年来生物类似药的研发成为药物研发的一个热点。中国已经上市了2个利妥昔单抗(商品名:美罗华)的生物类似药,药物临床研究结果显示,在药代动力学、临床疗效、安全性和免疫原性等方面,生物类似药与原研药物高度相似,临床上可替代使用。
(三)滤泡性淋巴瘤(follicular lymphoma, FL)
FL是一类较为常见的惰性NHL,在西方国家约占NHL的22%,在中国占NHL的2.5%~6.6%。既往文献报道,中国FL患者中位发病年龄约为49岁。患者主要表现为多发淋巴结肿大,亦可累及骨髓、外周血、脾脏、韦氏环、胃肠道和软组织等,原发结外者少见。
1. 病理诊断
FL来源于生发中心的B细胞,形态学上表现为肿瘤细胞部分保留了滤泡生长的模式,WHO根据每个高倍镜视野内中心母细胞数量,将FL进一步分为1~3级。1级FL:每个高倍镜视野内中心母细胞数量为0~5个;2级FL:每个高倍镜视野内中心母细胞数量为6~15个;3级FL:每个高倍镜视野内中心母细胞数量>15个。其中,仍保留少数中心细胞为3a级,中心母细胞呈片状分布、不见中心细胞者为3b级。1~2级FL患者临床表现为惰性,3a级FL和3b级FL患者的治疗原则按照DLBCL进行。任何分级的FL中出现DLBCL成分,应诊断为DLBCL,并按照DLBCL进行治疗。
FL典型的免疫表型为CD20(+)、CD23(+/-)、CD10(+)、CD43(-)、BCL-2(+)、BCL-6(+)、CD5(-)、CCND1(-),部分病例可以出现BCL-2(-)或CD10(-)。同时应该检测Ki-67指数,FISH检测可以协助诊断。
2. 治疗
FL按照分期进行分层治疗和管理,分期常采用Ann Arbor分期系统。
(1)一线治疗
①Ⅰ~Ⅱ期FL:放疗是目前Ⅰ~Ⅱ期FL的标准治疗。放疗联合全身治疗(化疗、CD20单抗单药治疗或者CD20单抗联合化疗)组患者的无失败生存期和无进展生存时间(progression-free survival, PFS)优于单纯放疗组,但OS无统计学差异。对于不伴有大肿块(肿块长径<7 cm)的Ⅰ~Ⅱ期FL可采用局部放疗,对于伴有大肿块(肿块长径≥7 cm)的Ⅰ~Ⅱ期FL患者,可采用抗CD20单抗±化疗±放疗。
②Ⅲ~Ⅳ期FL:Ⅲ~Ⅳ期FL患者治疗前需要评价是否具有治疗指征,治疗指征包括:出现肿瘤相关症状、器官功能障碍、肿瘤引起的全血细胞减少、大肿块(超过3个淋巴结区受累且每个淋巴结区至少存在1枚长径≥3 cm的淋巴结,或任何1枚淋巴结或结外肿块长径≥7 cm)、疾病持续进展和参加合适的临床试验。观察等待是无治疗指征Ⅲ~Ⅳ期FL的首选治疗策略,采取观察等待的患者应每3~6个月复查随访1次。有治疗指征的Ⅲ~Ⅳ期FL患者可选择的治疗方案较多,如单纯化疗、CD20单抗单药治疗或联合其他药物治疗、参加合适的临床试验或局部放疗。总的原则是根据患者年龄、PS、合并症和治疗目标,个体化选择治疗方案。对于老年患者、一般状况差且无法耐受较强化疗或预后较好的FL患者可选择单药治疗,主要包括烷化剂、嘌呤类似物、利妥昔单抗和放射免疫治疗药物等。基于GALLIUM研究,FDA于2017年11月16日批准奥妥珠单抗联合其他化疗药物治疗初治的成人Ⅱ期伴大肿块、Ⅲ~Ⅳ期FL。NMPA于2021年6月3日批准奥妥珠单抗上市,与化疗联用,随后用奥妥珠单抗维持治疗,用于初治的FL患者;或与苯达莫司汀联用,随后用奥妥珠单抗维持治疗,用于利妥昔单抗或含利妥昔单抗方案治疗无缓解或治疗期间或治疗后疾病进展的FL患者。用于治疗FL的多药联合方案主要有利妥昔单抗或奥妥珠单抗(R/G)+苯达莫司汀、R/G-CHOP方案、R/G-CVP方案(环磷酰胺+长春新碱+泼尼松)、R2方案(利妥昔单抗+来那度胺)等。
由于FL具有进展缓慢、反复复发的特点,诱导或解救治疗获得缓解后采用维持治疗可能会延长缓解时间、降低复发率。目前推荐用于维持治疗的药物为利妥昔单抗,EORTC 20981研究结果显示,与观察组相比,利妥昔单抗维持治疗能延长复发难治性FL患者的PFS。PRIMA研究结果显示,对于一线免疫化疗后的FL患者,与观察组相比,利妥昔单抗维持治疗能够显著延长PFS。
(2)复发或难治性患者的治疗
对于复发或难治性FL,应重新行病灶活检,明确是否存在组织学转化。对于病理确认为复发或难治性FL,仍需要判断患者是否存在治疗指征,对于无治疗指征的患者,可观察等待;对于具有治疗指征的患者,选择二线治疗方案或者参加合适的临床试验。二线及后线治疗方案需要根据既往治疗方案的疗效、缓解持续时间、患者年龄、PS等情况进行综合考虑。可选择的二线及后线治疗方案包括苯达莫司汀单药、R/G+苯达莫司汀、R/G+CHOP方案、R/G-CVP方案、R2方案、R/G单药及来那度胺单药等。基于C18083/3076研究,2018年12月17日NMPA批准苯达莫司汀上市,适应证为利妥昔单抗或含利妥昔单抗方案治疗过程中或者治疗后病情进展的惰性B细胞NHL。
一些新药在复发难治性FL中显示出了疗效,包括PI3K抑制剂Idelalisib、Copanlisib、Duvelisib和EZH2抑制剂Tazemetostat等。对于二线及后线治疗获得缓解的患者,利妥昔单抗维持治疗仍然能给患者带来生存获益,对于应用利妥昔单抗治疗后复发的患者,后续巩固治疗可以选择奥妥珠单抗。对于二线及后线治疗取得缓解的患者,ASCT也是后续治疗的选择之一。
3. 预后因素
FL国际预后指数(follicular lymphoma international prognostic index, FLIPI)有助于评估患者预后和选择治疗方案,FLIPI包括:(1)年龄≥60岁;(2)Ann Arbor分期Ⅲ~Ⅳ期;(3)血红蛋白<120 g/L;(4)血清LDH高于正常;(5)受侵淋巴结区≥5个。每项为1分,0~1分为低危组,2分为中危组,≥3分为高危组。低危、中危和高危组患者的10年总生存率分别为71%、51%和36%。FLIPI2为利妥昔单抗时代FL的预后模型,包括:(1)年龄≥60岁;(2)淋巴结长径>6 cm;(3)骨髓侵犯;(4)β2微球蛋白升高;(5)血红蛋白<120 g/L。每项为1分,0~1分为低危组,2分为中危组,≥3分为高危组。低危、中危和高危患者的5年总生存率分别为98%、88%和77%,5年无进展生存率分别为79%、51%和20%。
(四)边缘区淋巴瘤(marginal zone lymphoma, MZL)
MZL是一组异质性疾病,包括黏膜相关淋巴组织(mucosa-associated lymphoid tissues, MALT)淋巴瘤、结内边缘区淋巴瘤及脾边缘区淋巴瘤(splenic marginal zone lymphoma, SMZL)3种亚型,三者在形态学、免疫表型和基因表型方面相似,但其临床表现各异。其中MALT淋巴瘤最常见。
1. 病因学及临床表现
(1)病因学:MZL的病因与慢性感染或炎症所致的持续免疫刺激有关,胃MALT淋巴瘤与Hp的慢性感染有关,小肠MALT淋巴瘤与空肠弯曲菌感染有关,甲状腺MALT淋巴瘤与桥本氏甲状腺炎有关,腮腺MALT淋巴瘤与干燥综合征有关,22%~35%的淋巴结MZL、脾脏MZL和非胃MALT淋巴瘤中存在HCV感染。
(2)临床表现:胃肠道是结外MALT淋巴瘤最常见的原发部位,约占所有MALT淋巴瘤的50%。其他常见部位包括眼附属器、腮腺、肺部、甲状腺和皮肤等,约15%~20%的患者存在骨髓受侵。大部分MALT淋巴瘤为局限性疾病,约有1/3的患者表现为播散性。
2. 病理诊断
MZL的病理诊断更多的是一种排除法,形态学特征包括淋巴结和脾脏的生发中心缩小、边缘区增宽。MZL典型的免疫表型为CD5(-)、CD10(-)、CD20(+)、CD23(-/+)、CD43(-/+)、CyclinD1(-)以及BCL2(-)。t(11;18)、t(1;14)、t(14;18)和t(3;14)是MALT中比较常见的染色体改变。
3. 治疗
MZL的治疗需要按原发部位分层治疗。
(1)MALT淋巴瘤
①原发胃MALT淋巴瘤
主要包括抗Hp、手术、放疗以及化疗等综合治疗手段。
(a)Ⅰ~Ⅱ1期患者:由于Hp在局限期胃MALT淋巴瘤的发生过程中起到了重要作用,因此在治疗前必须进行Hp的相关检测,判断感染情况,决定是否需要行抗Hp治疗。Hp阳性的患者均应首先行抗Hp治疗。对于疗前Hp阳性、t(11;18)阳性的患者,推荐行抗Hp感染治疗+ISRT,如ISRT有禁忌,也可联合利妥昔单抗治疗。对于Hp阳性、t(11;18)状态不明或阴性的患者,推荐首先接受抗Hp治疗。对于疗前Hp阴性的患者,首选ISRT;如存在ISRT禁忌证,可选择利妥昔单抗治疗。初治患者在治疗3个月后需复查内镜和活检以评价疗效。如肿瘤无残存且Hp为阴性,可定期复查;如肿瘤残存而Hp阴性,患者无症状可再观察3个月后复查或接受ISRT,有症状者应接受ISRT;对于肿瘤无残存而Hp阳性的患者,应接受二线抗Hp治疗;如肿瘤残存且Hp阳性,疾病无进展可考虑二线抗Hp治疗,疾病较疗前进展,应考虑二线抗Hp治疗+ISRT。
对于抗Hp治疗后局部复发的患者,推荐行ISRT;抗Hp治疗序贯ISRT后复发的患者,需要评估是否具有治疗指征。无症状、无治疗指征的患者可以观察,对于有治疗指征的患者可接受利妥昔单抗联合化疗。
(b)ⅡE、Ⅱ2和Ⅳ期患者:对于无治疗指征、无症状的ⅡE、Ⅱ2和Ⅳ期患者可以观察等待。治疗指征包括影响器官功能、淋巴瘤相关症状(如胃肠道出血、腹胀等)、大肿块、疾病持续进展或患者有治疗意愿。患者可以接受利妥昔单抗联合化疗或ISRT。针对特定情况,如危及生命的胃肠道出血,可以采取手术治疗。
②非胃原发MALT淋巴瘤
对于非胃MALT淋巴瘤,ISRT具有良好疗效;利妥昔单抗也可以作为治疗选择;对于某些特定部位的结外MALT淋巴瘤(如肺、甲状腺、结肠、小肠、乳腺等),可选择手术切除,如切缘阳性,术后应接受局部区域ISRT,切缘阴性可以选择观察等待。
(2)淋巴结MZL
①Ⅰ~Ⅱ期患者:对于Ⅰ期和局限Ⅱ期患者,推荐ISRT,也可考虑ISRT+利妥昔单抗±化疗;对于广泛Ⅱ期患者,推荐利妥昔单抗±化疗±ISRT,无症状者也可以按照Ⅲ~Ⅳ期患者的治疗原则选择观察等待。
②Ⅲ~Ⅳ期患者:对于无治疗指征的Ⅲ~Ⅳ期患者,推荐观察等待;对于具有治疗指征的患者,推荐利妥昔单抗联合化疗。治疗指征包括出现淋巴瘤相关症状、影响器官功能、继发于淋巴瘤的血细胞减少、大肿块、脾大、6个月内疾病持续进展。
③一线治疗后的巩固治疗:对于一线治疗后达到CR或PR的患者,推荐观察等待;对于一线接受利妥昔单抗单药治疗的患者,推荐利妥昔单抗维持治疗。
④二线及二线以后的治疗:一线治疗后出现复发或进展的患者,如无治疗指征,常常能够再次从观察等待中获益。进展及复发难治性患者的治疗指征和一线治疗的指征类似。对于出现LDH升高、局部淋巴结持续增长、出现结外受累、出现新症状、进展及复发的患者,需要再次进行肿瘤组织活检,以明确是否出现病理类型转化。二线及二线以后的治疗推荐利妥昔单抗联合化疗。
(3)SMZL
①无脾大者:对于无脾大、无症状或无进展性血细胞减少的SMZL患者,可采取观察等待的策略。
②脾大伴HCV阳性者:HCV阳性的患者应评估肝功能,如无禁忌证,应行抗HCV治疗。对于HCV阳性的SMZL患者,合适的抗HCV治疗显示出良好疗效;对于抗病毒治疗无效或者有禁忌证的HCV阳性患者,应该按照HCV阴性患者的治疗原则进行治疗。
③脾大伴HCV阴性者:如患者无症状,可以采取观察等待策略。对于有症状的患者,可以采取利妥昔单抗单药治疗,后续可选择维持或不维持治疗。对于利妥昔单抗治疗无效的患者,可采取脾切除。
(五)CLL/小淋巴细胞淋巴瘤(small lymphocytic lymphoma, SLL)
CLL/SLL在欧美国家约占NHL的7%~10%,是欧美国家最常见的白血病类型,在美国所有白血病患者中占25%~30%。中国CLL/SLL的发病率较低,约占NHL的6%~7%。CLL/SLL中位发病年龄65岁,男女比例1.5~2∶1。
1. 诊断和分期
CLL/SLL属于惰性B细胞淋巴瘤,CLL和SLL是同一种疾病的不同表现,CLL以骨髓和外周血受累为主要特征,SLL通常以淋巴结病变为主。
(1)诊断:CLL的诊断标准主要包括:①外周血单克隆B淋巴细胞计数≥5×109/L;②外周血涂片形态学表现为小的、成熟的淋巴细胞显著增多;外周血淋巴细胞中不典型的淋巴细胞及幼稚淋巴细胞<55%;③典型流式细胞免疫表型表现为CD19(+)、CD5(+)、CD23(+)、CD200(+)、CD10(-)、FMC7(-)、CD43(+),sIg、CD20及CD79b弱表达。SLL的诊断标准主要包括:①淋巴结和(或)肝脾肿大;②无血细胞减少;③外周血单克隆B淋巴细胞计数<5×109/L。
(2)分期:由于CLL患者普遍存在骨髓和外周血受侵,多釆用Binet分期或Rai分期(表12),SLL采取Lugano分期(表2)。

2. 治疗
Rai分期为0~Ⅱ期的低危和中危CLL患者,如无治疗指征可以观察等待;有治疗指征时按照FISH检测del(17p)、TP53基因突变、CpG寡核苷酸刺激核型及免疫球蛋白重链可变区(immunoglobulin heavy chain variable region,IGHV)突变结果、患者一般状态和合并症情况,选择相应的治疗方案。Ⅲ~Ⅳ期患者如有进行性血细胞减少,按照FISH检测del(17p)、TP53基因突变、CpG寡核苷酸刺激核型及IGHV突变结果、患者一般状态和合并症情况,选择相应的治疗方案。
(1)治疗指征
有合适的临床试验;出现明显的疾病相关症状,
如严重乏力、盗汗、体重下降和非感染性发热;威胁脏器功能;持续增大的大肿块,如脾大超过左肋缘下6 cm,淋巴结长径>10 cm;淋巴细胞计数>(200~300)×109/L;存在白细胞淤滞症状;进行性贫血或进行性血小板下降;类固醇难治的自身免疫性血细胞减少。
(2)一线治疗
①无del(17p)/TP53基因突变的CLL/SLL患者需根据患者年龄及体能情况采取分层治疗方案。
(a)年龄<65岁且无严重合并疾病的患者:一线优先推荐伊布替尼单药治疗,也可选择苯达莫司汀+利妥昔单抗、FCR方案(氟达拉滨+环磷酰胺+利妥昔单抗)、FR方案(氟达拉滨+利妥昔单抗)、大剂量甲强龙+利妥昔单抗、伊布替尼+利妥昔单抗、维奈托克+奥妥珠单抗、阿卡替尼±奥妥珠单抗方案。
(b)年龄≥65岁或<65岁有合并疾病(肌酐清除率<70 ml/min)的CLL/SLL患者:优先推荐伊布替尼单药治疗。其他可选择的方案包括苯达莫司汀+利妥昔单抗、苯丁酸氮芥+利妥昔单抗、大剂量甲强龙+利妥昔单抗、维奈托克+奥妥珠单抗、伊布替尼+奥妥珠单抗、苯丁酸氮芥单药、利妥昔单抗或奥妥珠单抗单药等。
(c)体弱、伴严重合并疾病、不能耐受嘌呤类药物治疗的患者:推荐伊布替尼、苯丁酸氮芥+利妥昔单抗,也可选择大剂量甲强龙+利妥昔单抗、利妥昔单抗单药和苯丁酸氮芥单药治疗。
②有del(17p)/TP53基因突变或染色体复杂核型的CLL/SLL患者
有del(17p)/TP53基因突变或染色体复杂核型的CLL/SLL患者,对利妥昔单抗联合化疗方案疗效均欠佳,建议参加合适的临床试验或伊布替尼单药治疗。其余可选择的方案包括大剂量甲强龙+利妥昔单抗、奥妥珠单抗、维奈托克+奥妥珠单抗等。
基于RESONATE-2研究,伊布替尼于2016年3月4日获FDA批准用于CLL患者的一线治疗。基于CLL14研究和ELEVATE-TN研究,FDA分别于2019年5月15日和2019年11月21日批准维奈托克+奥妥珠单抗方案和阿卡替尼单药一线治疗CLL/SLL成人患者,但维奈托克和阿卡替尼目前尚未在中国上市。
(3)一线治疗后的维持治疗
一线治疗后的高危患者[外周血中微小残存肿瘤(minimal residual disease, MRD)≥10-2、10-4≤MRD<10-2伴IGHV基因无突变、伴del(17p)/TP53基因突变],可考虑来那度胺维持治疗。一线治疗使用伊布替尼治疗者,维持治疗可继续应用伊布替尼。
(4)复发或难治性患者的治疗
考虑患者为复发或难治性CLL/SLL前,必须再次确认CLL/SLL的诊断。开始下一步治疗前,应再次行FISH del(17p)检测,并再次行TP53突变检测。
① 无del(17p)/TP53基因突变的患者
(a)年龄<65岁且无严重合并疾病的患者:优先推荐应用伊布替尼、泽布替尼和奥布替尼,还可选择来那度胺±利妥昔单抗、BR方案(苯达莫司汀+利妥昔单抗)、FCR方案、大剂量甲强龙+利妥昔单抗、BR+伊布替尼、维奈托克+利妥昔单抗、维奈托克单药方案等。
(b)年龄≥65岁或<65岁有合并疾病(肌酐清除率<70 ml/min)的患者:优先推荐伊布替尼、泽布替尼和奥布替尼,还可以应用苯丁酸氮芥+利妥昔单抗、来那度胺±利妥昔单抗、减低剂量的FCR方案、大剂量甲强龙+利妥昔单抗、BR±伊布替尼、维奈托克+利妥昔单抗、维奈托克单药方案等。
②有del(17p)/TP53基因突变的患者
推荐伊布替尼、泽布替尼和奥布替尼,还可选择大剂量甲强龙+利妥昔单抗、来那度胺±利妥昔单抗、维奈托克+利妥昔单抗、维奈托克单药方案等。
伊布替尼于2014年2月被FDA批准用于治疗既往接受过至少一次治疗的CLL患者,于2017年8月30日经NMPA批准在中国上市,用于既往至少接受过一种治疗的CLL/SLL患者。基于一项Ⅱ期临床研究结果,2020年6月3日,泽布替尼获NMPA批准上市,用于既往至少接受过1种方案治疗的CLL/SLL患者。奥布替尼于2020年12月25日获NMPA批准上市,用于既往至少接受过1种方案治疗的成人CLL/SLL患者。2018年6月8日FDA批准维奈托克与利妥昔单抗联合用于既往至少接受过1种方案治疗、伴或不伴del(17p)的CLL/SLL患者。另外,Idelalisib、Ofatumumab和Duvelisib分别于2014年7月23日、2017年6月23日和2018年9月24日被FDA批准用于复发难治性CLL/SLL的治疗,但这3种药物目前均尚未在中国上市。
(5)二线及二线治疗后的维持治疗
二线及二线治疗后可考虑来那度胺维持治疗,既往使用伊布替尼治疗者,维持治疗可继续应用伊布替尼。
3. 预后
CLL/SLL患者中位生存时间约为10年,但患者预后具有异质性。临床、实验室指标以及分子生物学标志物可作为预后因素。目前常用慢性淋巴细胞白血病国际预后指数(chronic lymphocytic leukemia international prognostic index, CLL-IPI)评估预后(表13), 0~1分为低危;2~3分为中危;4~6分为高危;7~10分为极高危。CLL-IPI低危、中危、高危、极高危者5年生存率分别为93.2%、79.2%、63.6%和23.2%。

(六)MCL
MCL在美国和欧洲约占成人NHL的7%,在中国约占所有NHL的5%,是一类兼具有惰性和侵袭性淋巴瘤特征的NHL。男女比例为2~3∶1,诊断的中位年龄约65岁。
1. 病理特征
MCL需要结合组织学形态和分子表型进行诊断,其典型的免疫表型为CD5(+)、CD19(+)、CD20(+),CD23(-)或弱(+)、CD200(-/弱+)、CD43(+),强表达sIgM或IgD,但通常CD10(-)、CD11c(-)、BCL-6(-)。病理特征为t(11;14)(q13;q32)和Cyclin D1过表达,分子遗传学改变包括CCND1、SOX11等基因突变。另外,Ki-67指数作为预后的指标也应当纳入检测。在接受传统治疗的MCL患者中,TP53突变与更差的预后有关,行TP53基因检测有助于判断患者预后。
2. 治疗
MCL预后较差,目前尚无标准的治疗方案,许多化疗方案有较高的治疗有效率,但晚期患者通常仍不能治愈。
(1)一线治疗
①Ⅰ期或不伴有大肿块的Ⅱ期MCL
推荐采用ISRT,或利妥昔单抗联合化疗±ISRT。
② 伴有大肿块的Ⅱ期或Ⅲ~Ⅳ期患者
MCL治疗原则是根据生物学特性制定的,IGHV突变伴SOX11阴性的非淋巴结性白血病型MCL具有惰性病程的特点,如无症状并且无治疗指征,可选择观察和等待;如有症状,应评估临床转化的风险,如TP53基因突变阴性,按照侵袭性MCL治疗;如TP53基因突变阳性,目前尚无标准治疗,可采用侵袭性MCL的治疗方案,获得CR的患者后续可行ASCT。
侵袭性MCL的治疗应该根据患者年龄、疾病分期、一般状态、是否可行ASCT选择合适的治疗手段。(a)年龄>65岁和(或)一般状况较差、不适合ASCT的患者:推荐参加合适的临床试验,或采用常规剂量诱导治疗方案。常规剂量诱导治疗方案包括BR方案、VR-CAP方案(硼替佐米+利妥昔单抗+环磷酰胺+多柔比星+泼尼松)、R-CHOP方案、R2方案,其他方案还包括改良的R-HyperCVAD方案(适用于<65岁患者)以及RBAC500方案(利妥昔单抗+苯达莫司汀+阿糖胞苷)等。诱导治疗达到CR的患者应采用利妥昔单抗维持治疗。
(b)年龄≤65岁且一般状况较好、适合ASCT的患者:推荐参加合适的临床试验或采用高强度的诱导治疗方案。高强度的诱导治疗方案包括R-DHA(利妥昔单抗+地塞米松+阿糖胞苷)+铂类(卡铂或顺铂或奥沙利铂)方案、R-CHOP与R-DHAP交替方案、NORDIC方案(高剂量R-CHOP与利妥昔单抗+高剂量阿糖胞苷交替)、R-HyperCVAD方案、利妥昔单抗+苯达莫司汀序贯利妥昔单抗+高剂量阿糖胞苷,其他推荐的方案还包括苯达莫司汀+利妥昔单抗。诱导治疗达到CR后行ASCT巩固治疗,之后应用利妥昔单抗维持治疗3年。
(2)复发或难治性患者的治疗
复发或难治性MCL尚无标准治疗方案,可以选择一线治疗时未使用的方案。目前二线及以上推荐的方案包括伊布替尼±利妥昔单抗、泽布替尼、奥布替尼、来那度胺+利妥昔单抗;其他可选择的方案包括BR方案、RBAC500方案、硼替佐米±利妥昔单抗、R-DHAP方案、R-DHAX方案、GemOx方案、伊布替尼+来那度胺+利妥昔单抗、伊布替尼+维奈托克、维奈托克±利妥昔单抗等。基于一项Ⅱ期临床研究结果,FDA于2013年11月13日批准伊布替尼用于一线治疗失败的MCL患者的治疗。2017年8月30日,NMPA批准伊布替尼在中国上市,用于既往至少接受过1种方案治疗的MCL患者。FDA和NMPA分别于2019年11月15日和2020年6月3日批准泽布替尼上市,用于既往接受过至少1种方案治疗的成人MCL患者。2020年12月25日,奥布替尼被NMPA批准上市,适应证为既往至少接受过1种方案治疗的MCL患者的治疗。二线治疗后获得CR的患者可采用allo-SCT巩固治疗。
3. 预后因素
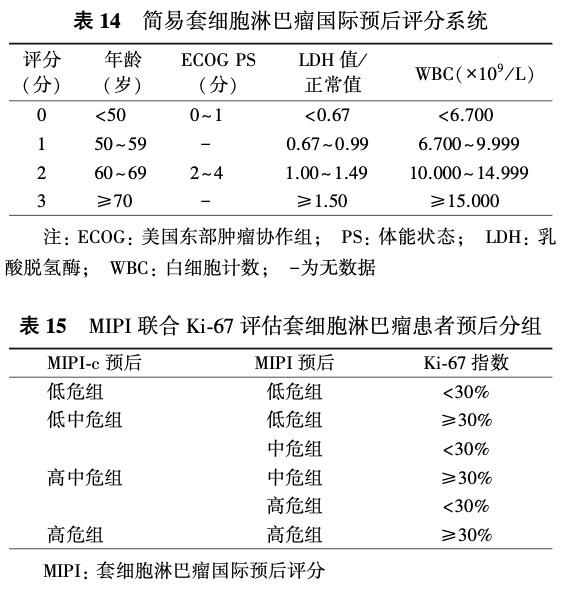
相比IPI,简易套细胞淋巴瘤国际预后评分系统(mantle cell lymphoma international prognostic index, MIPI)对MCL的预后分层效果更好,目前被广泛应用(表14),0~3分为低危组,4~5分为中危组,6~11分为高危组。Ki-67是MCL中独立于MIPI的一个重要的预后指标,Ki-67>30%与MCL的不良预后有关。其他不良预后因素还包括TP53突变和母细胞转化等。结合Ki-67和MIPI的联合评分系统被认为能够更好地预测MCL患者的预后(表15)。
(七)伯基特淋巴瘤(Burkitt lymphoma, BL)
BL占所有NHL的1%~3%,占儿童NHL的40%。
BL属于高度侵袭性NHL,可分为地方流行型、散发型和免疫缺陷相关型等3个变异型。散发型BL主要见于发达国家,占成人NHL的1%~5%,占儿童淋巴瘤的30%,主要发生在儿童和青年中,男女比例为3∶1~2∶1,EBV阳性率<30%;地方流行型BL主要见于赤道附近的非洲国家,约占该地区儿童肿瘤的30%~50%,与EBV及地方性疟疾感染高度相关,EBV阳性率>95%;免疫缺陷相关型BL主要见于HIV感染人群或器官移植的患者。
1. 临床特点
地方流行型BL最常出现下颌骨病灶,可以累及远端回肠、肾、乳腺和长骨等结外组织和器官。散发型成人BL以腹腔大肿块,特别是回盲部肿块为常见临床表现,面部特别是下颌骨受累罕见。BL是细胞倍增周期时间最短的肿瘤,生长迅速。BL结外受侵常见,头颈、腹部、骨髓和中枢神经系统等是其常见的受累部位。
2. 病理诊断
经典型BL形态学表现为较均一的中等大小肿瘤性B细胞弥漫增生,核分裂象及凋亡很明显,常见星空现象。肿瘤细胞起源于生发中心,免疫表型常表现为sIgM(+)、单一轻链(+)、CD19(+)、CD20(+)、CD22(+)、c-Myc(+)、CD10(+)和BCL-6(+)、BCL-2(-)、CD5(-)、CD23(-)、MUM-1(-)和TdT(-)。BL增殖指数非常高,Ki-67阳性率近100%。即使形态学、免疫表型都为典型的BL,也要用FISH进行MYC检测,其中t(8;14)占约80%,t(2;8)和t(8;22)占15%;鉴别诊断包括伴MYC、BCL-2和(或)BCL-6重排的高级别B细胞淋巴瘤和BL伴11q异常。EBV-EBER检测对BL是必须的,约100%的地方流行型BL、30%的散发型BL及40%的免疫缺陷型BL存在EBV感染。
2016年WHO造血与淋巴系统肿瘤分类新提出“伴11q异常BL”,其基因表达谱和临床特点与经典BL类似,但无MYC基因异常,而是具有11q染色体改变。当BL同时伴有MYC、BCL-2和(或)BCL-6重排时,则从经典BL类型中独立出来,归入伴有MYC、BCL-2和(或)BCL-6重排的高级别B细胞淋巴瘤。
3. 治疗
(1)一线治疗:BL患者的一线治疗以化疗为主,一般不推荐放疗,即便为局限性病变也应采取全身治疗的策略,诊断后应尽早开始治疗,采用短疗程高强度的多药联合方案化疗。联合利妥昔单抗可以改善患者长期生存,特别是>60岁的患者获益更大。应进行CNS预防性治疗,并充分预防肿瘤溶解综合征的发生。LDH正常、Ⅰ期且腹腔肿块完全切除或单个腹腔外肿块直径<10 cm为低危患者,此外均为高危患者。<60岁的低危患者可选择的诱导治疗方案包括CODOX-M-R方案(环磷酰胺+长春新碱+阿霉素+高剂量甲氨蝶呤+利妥昔单抗),或DA-EPOCH-R方案,或R-HyperCVAD方案;<60岁的高危患者可选择CODOX-M-R或R-HyperCVAD方案,不能耐受强化疗方案的患者可选择DA-EPOCH-R方案,治疗起始合并症状性CNS受累的患者治疗中应包含能透过血脑屏障的药物。对于≥60岁的低危和高危患者,治疗选择均为DA-EPOCH-R方案。若患者达到CR,则进行随访:第1年每2~3个月随访1次,第2年每3个月随访1次,之后每6个月随访1次。若患者治疗后未达CR,则参加合适的临床试验或姑息性ISRT。
(2)复发或难治性患者的治疗:若患者一线治疗后>6~18个月疾病复发,则推荐参加合适的临床试验或接受二线方案治疗或进行最佳支持治疗。二线化疗可采用R-ICE方案、R-GDP方案、R-IVAC方案(利妥昔单抗+依托泊苷+异环磷酰胺+阿糖胞苷)、高剂量阿糖胞苷+利妥昔单抗等方案。二线治疗后若患者达CR,可考虑ASCT±ISRT,或考虑allo-SCT±ISRT;若患者达PR,则继续进行二线方案治疗、ASCT±ISRT或allo-SCT±ISRT;若患者达SD或PD,则推荐参加合适的临床试验或包括姑息性ISRT在内的最佳支持治疗。若患者一线治疗后<6个月复发,则考虑参加合适的临床试验或最佳支持治疗。
4. 预后因素
散发型、成人、晚期、LDH升高、骨髓和CNS受侵和HIV阳性为BL不良预后因素。
(八)淋巴母细胞淋巴瘤(lymphoblastic lymphoma, LBL)
LBL约占成人NHL的2%~4%,儿童或青少年更常见。男性多见,男女之比超过2.5∶1。LBL可以分为T细胞来源(T-LBL)和B细胞来源(B-LBL),T-LBL占LBL的80%以上,B-LBL约占LBL的10%~15%。LBL与急性淋巴细胞白血病(acute lymphocytic leukemia, ALL)有相似的临床和实验室特征,包括细胞形态学、免疫表型、基因型、细胞遗传学以及临床表现和预后,因此,WHO造血和淋巴组织肿瘤分类(2016年修订版)将二者共同归于前体淋巴细胞肿瘤,命名为前体T/B淋巴母细胞白血病/淋巴瘤(T/B-ALL/LBL)。但LBL与ALL在临床特点上有所不同,通常将以肿块性病变为主要表现的归为淋巴瘤,而将以外周血和骨髓广泛受侵为主要表现的归为白血病。当临床以肿瘤性病灶起病而无骨髓及外周血受侵或骨髓中肿瘤性淋巴母细胞<25%时诊断为LBL;当有骨髓和外周血受侵,骨髓中淋巴母细胞≥25%时,则诊断为ALL。
1. 临床表现
T-LBL的典型临床表现为颈部淋巴结肿大伴前纵隔巨大肿块所致的咳嗽、气短、上腔静脉阻塞,可伴有胸腔积液、心包积液等。淋巴结病变以颈部、腋下和锁骨上淋巴结多见,可伴有淋巴瘤的全身症状,病变发展迅速,多数患者就诊时处于Ⅲ~Ⅳ期,易于侵犯结外器官,特别是骨髓和CNS。B-LBL往往表现为淋巴结肿大,以皮肤、软组织、骨、骨髓和CNS受侵常见,分期多为Ⅲ~Ⅳ期,常伴B症状、LDH升高。
2. 病理诊断
在细胞形态上,T-ALL/LBL的瘤细胞与B-ALL/LBL的瘤细胞无法区分,肿瘤细胞体积中等大小,胞质少,核浆比高,细胞核为圆形、椭圆形或不规则形,核膜清楚而薄,染色质细而分散,核仁常不明显(大的母细胞核仁相对明显),核分裂象多见。淋巴结受累时,淋巴结结构通常完全破坏,伴有被膜累及,可见到“星空”现象。有时纤维组织增生分隔成多结节状。软组织中浸润的细胞通常呈单行排列。LBL免疫表型以TdT阳性为特点,也可以增加CD99、CD10协助母细胞分化的判定。其中B-LBL的免疫表型为sIg(-)、cIg(+)、CD10(+/-)、CD19(+)、CD20(-/+)、TdT(+)、PAX5(+);T-LBL的免疫表型为sIg(-)、CD10(-)、CD19(-)/CD20(-)、CD3ε(+/-)、CD2(+)、CD4(+)、CD8(+)、CD1α(+/-)、CD7(+)、TdT(+)。CD7、CD43不能单独作为T淋巴细胞的标志物。细胞幼稚时,需要增加CD34、CD117、MPO、Lys等检测,以鉴别急性髓细胞白血病。
3. 治疗
(1)一线治疗:LBL属于高度侵袭性淋巴瘤,无论是Ⅰ期还是Ⅳ期患者,均应按全身性疾病治疗。CHOP方案治疗效果差,临床上LBL患者多按照ALL的治疗原则进行治疗,儿童ALL治疗效果优于成人。治疗过程包括诱导治疗、巩固强化、维持治疗等阶段。诱导治疗推荐采用Berlin-Farnkfurt-Münster方案(环磷酰胺+长春新碱+柔红霉素+地塞米松+阿糖胞苷+甲氨蝶呤+培门冬酶和强的松),也可以采用HyperCVAD方案。诱导治疗达到CR后应继续进行巩固强化治疗,巩固强化治疗方案通常采用高剂量阿糖胞苷+高剂量甲氨蝶呤。对无骨髓受侵的患者,可以考虑在巩固化疗后尽快行ASCT。ASCT后的患者应给予甲氨蝶呤+6-巯基嘌呤(6-MP)或6-硫代鸟嘌呤(6-TG)维持治疗,总的治疗周期至少2年。预防性鞘内注射有利于降低CNS复发风险,应尽早开始腰椎穿刺、鞘内注射进行CNS预防治疗,常用的鞘内注射药物有甲氨蝶呤、阿糖胞苷和皮质类固醇等。纵隔是LBL最主要的复发部位,放疗可降低纵隔复发率。由于纵隔放疗的诸多不良反应,不推荐用于儿童LBL的常规治疗,可作为成人LBL的巩固治疗手段。
(2)复发或难治性患者的治疗:初治高危和复发或难治性的患者,可以选择参加合适的临床试验等,有条件的患者可考虑allo-SCT。
4. 预后
成人LBL预后明显差于儿童,不良预后因素包括CNS受累、诱导化疗结束后有残存病变等。
(九)外周T细胞淋巴瘤,非特指型(peripheral T-cell lymphoma,not otherwise specified, PTCL-NOS)
PTCL是起源于胸腺后成熟T细胞和NK细胞的一组异质性肿瘤。按照WHO造血和淋巴组织肿瘤分类淋巴瘤部分(2017年修订版),PTCL包括白血病型/播散型、淋巴结型、结外型和皮肤型。在欧美国家,PTCL占NHL的10%~15%,我国为21.4%。在欧美人群中,PTCL亚型发病率由高到低分别为PTCL-NOS、血管免疫母细胞性T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma, AITL)、结外NK/T细胞淋巴瘤,鼻型(extranodal NK/T-cell lymphoma, nasal type, ENKTL)、成人T细胞白血病/淋巴瘤、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)阳性和阴性ALCL,发病率分别为25.9%、18.5%、10.4%、9.6%、6.6%和5.5%,其他类型PTCL相对少见。在中国,由于EBV感染,ENKTL是最常见的PTCL亚型,其次为PTCL-NOS、AITL、ALK阳性及阴性ALCL,发病率分别为28.16%、19.88%、13.84%、7.34%和4.21%。
1. 临床表现
PTCL-NOS常见于中老年患者,中位发病年龄为55岁,无明显性别差异。PTCL-NOS多表现为浅表淋巴结肿大,半数患者伴有B症状。结外常累及皮肤及皮下组织、肝脾、消化道、甲状腺和骨髓等。患者初诊时多为Ⅲ~Ⅳ期。
2. 病理诊断
PTCL-NOS由于其在形态学、免疫学、遗传学和临床表现上均无特异性,所以只有在排除其他独立分型的T细胞淋巴瘤后,方能做出PTCL-NOS的诊断。组织病理学表现为异型的淋巴细胞分布于副皮质区或弥漫分布。肿瘤细胞通常会丢失一种或多种成熟T细胞抗原(CD5或CD7),表达T细胞受体(T-cell receptor, TCR),多为α或β型,一般不表达B细胞相关抗原。PTCL-NOS的TCR基因常表现为克隆性重排。PTCL-NOS包括3种亚型,分别以GATA3、TBX21和细胞毒基因过表达为特征,GATA3型预后差。需注意鉴别滤泡辅助T细胞来源的淋巴瘤。此外,当DLBCL的细胞多形性明显时,酷似T细胞特点,也需要进行鉴别,所以B细胞标志物(如CD20和PAX5等)的检查不可缺少。在伴有多量浆细胞增生时,注意浆细胞的克隆性。
3. 治疗
PTCL-NOS最佳治疗方案和治疗策略仍在探索中,推荐首选合适的临床试验。若无合适的临床试验,对IPI低危或低中危的Ⅰ~Ⅱ期患者给予4~6个周期化疗±局部放疗±ASCT。对于IPI高危或高中危的Ⅰ~Ⅳ期患者,给予6~8个周期化疗±局部放疗±ASCT。对于复发或难治性的PTCL-NOS患者,则推荐参加合适的临床试验、应用二线方案治疗或姑息性放疗。
(1)一线治疗:一线治疗推荐方案包括CHOEP方案(环磷酰胺+长春新碱+多柔比星+依托泊苷+泼尼松)、CHOP方案、DA-EPOCH方案、维布妥昔单抗+CHP方案(环磷酰胺+多柔比星+泼尼松,适用于CD30阳性的患者);其他推荐方案还包括CHOP方案序贯IVE方案(异环磷酰胺+依托泊苷+表柔比星)。一线治疗达到CR的患者可随访观察或行ASCT。造血干细胞移植能否改善患者生存尚缺乏前瞻性临床研究证实。但基于单臂的前瞻性或回顾性临床研究推荐患者行造血干细胞移植,尤其是IPI评分比较高的患者。对于局限期诱导化疗达CR的患者,也可考虑巩固放疗。一线化疗未达CR的患者,参照复发难治患者的治疗原则。
(2)复发或难治性患者的治疗:复发或难治性PTCL-NOS患者优先推荐参加合适的临床试验,否则接受二线治疗(包括局部放疗)。二线治疗方案的选择要结合是否计划进行移植、患者的一般状况和药物不良反应等因素综合考虑。二线全身治疗后获得CR或PR的患者序贯ASCT或allo-SCT。二线治疗的单药方案包括西达本胺、贝利司他、罗米地辛、普拉曲沙、维布妥昔单抗(针对CD30+PTCL)、吉西他滨、苯达莫司汀、来那度胺、硼替佐米等;可供选择的联合化疗方案包括DHAP方案、ESHAP方案、GDP方案、GemOx方案、GVD方案、ICE方案等。基于关键性注册Ⅱ期临床试验(CHIPEL研究)结果,NMPA于2014年12月23日批准西达本胺上市,用于既往至少接受过1次全身化疗的复发或难治性PTCL患者的治疗。基于一项Ⅱ期研究,2020年8月28日,NMPA批准普拉曲沙,用于治疗复发性或难治性PTCL。
4. 预后
PTCL-NOS总体预后差于侵袭性B细胞淋巴瘤,5年生存率约为30%。中国PTCL患者一线接受CHOP、CHOPE和GDP方案的中位PFS分别为6.0、15.3和9.7个月,1年生存率分别为65.0%、83.3%和100%。
PTCL-NOS预后评分系统包括IPI和PTCL-NOS预后指数(prognostic index for PTCL-NOS, PIT),PIT的危险因素包括年龄>60岁、LDH增高>正常值、ECOG PS 2~4分和骨髓受侵,每个危险因素为1分,风险分组包括1组(0分)、2组(1分)、3组(2分)和4组(3分)。
(十)蕈样霉菌病(mycosis fungoides, MF)和Sézary综合征(sézary syndrome, SS)
MF(又称蕈样肉芽肿)和SS是最常见的皮肤T细胞淋巴瘤(cutaneous T cell lymphoma, CTCL)。MF占CTCL的50%,而SS不太常见,仅占CTCL的5%。
1. 临床表现
MF临床表现为多发性皮肤红斑、斑块和瘤样结节,全身皮肤均可发生,常伴皮肤瘙痒。病程呈反复性进展,病变可局限于皮肤数月、数年、甚至数十年,在疾病晚期可发生淋巴结和内脏受侵。约10%MF患者的皮肤损害为广泛性红皮病。SS为一种独特的红皮病型CTCL,伴外周血受侵(循环中异常细胞占淋巴细胞比例>5%),在受侵的皮肤组织、淋巴结和外周血中可见到Sézary细胞。SS可能由斑片或斑块或红皮病型MF进展而来,也可能表现为新发典型的皮肤、血液系统和淋巴结受侵。
2. 病理诊断
MF的诊断比较困难,可能需要经过几年观察、多次活检才能确诊。小的、多形核淋巴细胞聚集在表皮或表皮真皮交界处,向表皮浸润,形成Pautrier微脓肿是其特点。MF和SS典型的免疫表型为CD2(+)、CD3(+)、CD5(+)、CD4(+)、CD8(-)、CCR4(+)、TCRβ(+)和CD45RO(+),无CD7和CD26表达。有一些MF亚型为CD8(+)或CD4和CD8双阴性。TCR克隆性重排对MF和SS的诊断有重要意义,流式细胞术对分期和与其他累及皮肤淋巴瘤的鉴别诊断有重要价值。
3. 分期
MF和SS的分期见EORTC的TNMB分期系统(表16、17)。

4. 治疗
MF和SS目前尚无根治性治疗方法,疾病分期是确定治疗方案的主要依据。早期病变(ⅠA期和ⅡA期)采用皮肤定向疗法,当ⅠB期和ⅡA期斑块性病变的范围比较广泛或皮肤定向疗法疗效不佳时,可结合全身系统治疗。ⅡB期、Ⅲ期、Ⅳ期和难治性病变采用以全身系统治疗为主的综合治疗或参加合适的临床试验。皮肤定向疗法包括局部应用皮质类固醇、局部化疗[氮芥(HN2)或卡莫司汀]、局部应用维A酸、局部应用咪喹莫特、局部应用贝沙罗汀、局部放疗(X射线或电子束)、光照疗法(中波紫外线或补骨脂素联合长波紫外线);全身治疗方法包括全皮肤电子束治疗(total skin electron beam therapy, TSEBT)、全身性生物疗法(小剂量甲氨蝶呤、维A酸类药物、干扰素、组蛋白去乙酰基酶抑制剂、维布妥昔单抗)、吉西他滨、脂质体阿霉素、环磷酰胺、硼替佐米、来那度胺、体外光分离置换疗法和造血干细胞移植等。
(1)早期病变的治疗:ⅠA期MF患者,可局部应用皮质类固醇治疗。对于斑块较薄且自然病程较为惰性的ⅠB期或ⅡA期患者,可局部应用皮质类固醇、HN2、卡莫司汀或窄谱中波紫外线。局限的难治性病变可局部应用贝沙罗汀、咪喹莫特或局部放疗。对于症状非常明显的泛发性厚斑块并需要迅速获得缓解的患者,建议采用TSEBT治疗或皮肤定向治疗联合全身性生物疗法。若皮肤定向治疗无效、皮肤病变广泛、症状严重或患者存在较差的预后特征,则使用全身性生物疗法。
(2)晚期或难治性患者的治疗:晚期MF通常是一种呈复发病程的慢性或持续性疾病。治疗的主要目标是尽可能长期控制疾病、迅速缓解症状以及管理危及生命的侵袭性疾病。长期控制疾病包括针对疾病类型和部位(如斑片或斑块、肿瘤、红皮病、皮肤外病变)的连续治疗,全身性治疗优先选择对免疫功能影响小的药物(以下全身性治疗指该类药物)。皮肤肿瘤累及体表面积较小(<10%体表面积)的患者,建议采用针对肿瘤的局部放疗,按需加用皮肤定向治疗。对于广泛性皮肤病变(>10%体表面积)的患者,可选择TSEBT或全身性治疗,TSEBT后可进行其他皮肤定向治疗或全身性治疗,以延长疗效持续时间。对于血液系统未受累的大多数泛发性红皮病患者(≥80%体表面积),可同时采用皮肤定向治疗(如外用类固醇)和全身性治疗。对于伴有血液系统受侵的患者,推荐使用全身性治疗。有临床侵袭性疾病的患者使用标准方案治疗获得长期疾病控制的可能性较小,需要更积极的治疗。对于具有侵袭性临床特征的患者,推荐使用起效较快且缓解率较高的药物,治疗选择包括伏立诺他、罗米地辛、贝沙罗汀、维布妥昔单抗、Mogamulizumab(KW-0761)、单药化疗或联合化疗。对于病情难以控制的患者,可考虑allo-SCT。
5. 预后
MF患者的预后较好,5年生存率约为90%;SS患者预后通常不佳,中位生存时间约为2~4年。国际皮肤淋巴瘤联合会的回顾性研究结果显示,Ⅳ期病变、年龄>60岁、LDH升高和皮肤大细胞转化是患者生存较差的独立预后影响因素。
(十一)ENKTL
ENKTL是EBV相关淋巴瘤,90%以上患者EBV呈阳性。ENKTL在亚洲和南美洲较常见,欧美极少见,绝大部分原发于结外。
1. 临床表现
ENKTL多见于男性,发病年龄较轻,B症状常见。肿瘤常局限于鼻腔或直接侵犯邻近结构或组织,邻近器官或结构受侵以同侧上颌窦和筛窦最常见,其他依次为鼻咽、局部皮肤、硬腭、软腭、眼球和口咽等,较少有远处淋巴结受侵或结外器官受侵。Ⅰ~Ⅱ期患者占70%~90%,Ⅲ~Ⅳ期患者占10%~30%,Ⅲ~Ⅳ期患者常出现肝脾肿大、皮肤、胃肠道、睾丸受侵。
2. 病理诊断
ENKTL病理学特征为弥漫性淋巴瘤细胞浸润,呈血管中心性、血管破坏性生长,导致组织缺血坏死以及黏膜溃疡。组织坏死很常见,是导致ENKTL漏诊的主要原因。ENKTL诊断所需IHC标志物包括CD3、CD56、CD2、CD4、CD5、CD7、CD8、CD45RO、CD20、PAX5、TIA-1、granzyme B、Ki-67及EBV-EBER等。ENKTL的典型免疫表型为CD2(+)、CD3(+)、CD56(+)、TIA-1(+)、granzyme B(+)和EBV-EBER(+)。EBV-EBER阴性时诊断要谨慎,如果CD56(+)、CD3(+)、细胞毒标志物均表达可以诊断为ENKTL,如果CD3(-)、CD56(-),则诊断PTCL-NOS。60%~90%的ENKTL无TCR基因重排。ENKTL还需注意与未分化癌相鉴别,应增加CK、EMA等上皮标志物检测。
3. 治疗
(1)一线治疗:任何期别的ENKTL患者参加合适的临床试验都是最佳选择。无危险因素的Ⅰ期ENKTL患者(年龄<60岁、ECOG PS 0~1分、LDH正常、无原发肿瘤局部广泛侵犯)可接受单纯放疗。有危险因素的Ⅰ期或Ⅱ期患者,可采用序贯化放疗、同步化放疗或夹心化放疗。由于ENKTL对含蒽环类药物的方案疗效不佳,推荐含左旋门冬酰胺酶或培门冬酶为基础的化疗方案,包括P-GemOx方案(吉西他滨+培门冬酶+奥沙利铂)、DDGP方案(顺铂+地塞米松+吉西他滨+培门冬酶)、剂量调整的SMILE方案(甲氨蝶呤+亚叶酸钙+异环磷酰胺+美司钠+地塞米松+依托泊苷+左旋门冬酰胺酶)和AspaMetDex方案(培门冬酶+高剂量甲氨蝶呤+地塞米松)等。
Ⅲ期或Ⅳ期ENKTL和任何期别的鼻外型病变患者可以采用左旋门冬酰胺酶或培门冬酶为基础的联合化疗方案±放疗,诱导化疗后获得CR或PR的患者,可行ASCT。
(2)复发或难治性患者的治疗:复发或难治性ENKTL患者首先推荐合适的临床试验。其他推荐方案包括单药或多药联合方案治疗,单药包括西达本胺、维布妥昔单抗(用于CD30阳性的患者)、普拉曲沙,多药联合方案包括一线治疗中未曾使用过含门冬酰胺酶的联合化疗方案、DHAP方案、ESHAP方案、GDP方案、GemOx方案和ICE方案。对于敏感复发的患者,若身体状态允许,在上述治疗获得缓解后可行ASCT,有合适供者的患者可考虑allo-SCT。对于化疗后局部进展或复发的患者可以考虑放疗。
4. 预后因素
目前ENKTL的预后模型包括PINK和PINK-E模型,PINK模型包括年龄>60岁、远处淋巴结侵犯、Ⅲ~Ⅳ期、鼻外原发;在PINK模型的基础上增加外周血EBV-DNA水平,形成了PINK-E模型。
淋巴瘤是一类异质性很强的恶性肿瘤,在诊疗过程中需要多学科协作,结合每位患者的特征制定个体化的治疗方案,从而提高诊断和治疗水平,改善患者预后。
由于临床实践中患者的具体情况存在较大的个体差异以及我们的水平有限,本指南仅供参考。
-----------END--------------













