如何让骨折快速完美的愈合一直是骨科治疗中最重要的课题之一,而某些因素及治疗却会直接影响着骨折的转归。今天早读就为大家详细讲解骨的结构、骨折的类型、影响骨折愈合的常见因素以及哪些治疗因素会影响骨折的愈合,值得大家学习收藏!
一
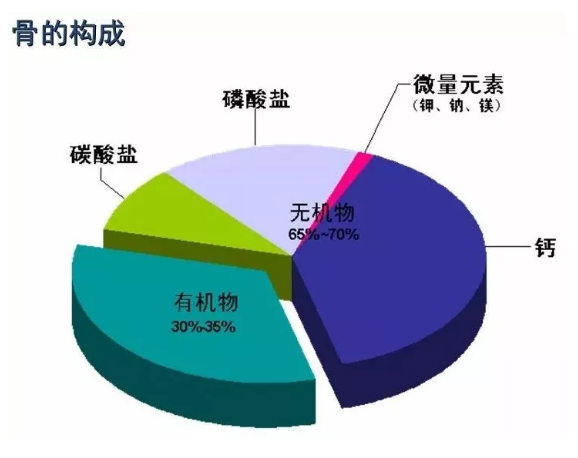
骨的结构
1、骨膜
骨外膜可分为内、外两层。外层致密,主要有许多胶原纤维束;内层疏松,含有丰富的骨原细胞,对骨的生长、再生和修复起重要作用,故又称生发层。
2、骨组织
骨组织也称为骨质,是骨的主要部分。骨组织在骨内的存在形式有两种,即密质骨和松质骨。
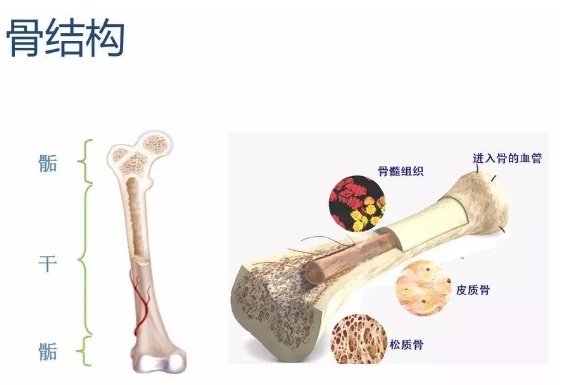
2.1密质骨由于密质骨的致密性好,因而其抗压、抗弯曲强度都很高。一些长骨的干和其他类型骨中的骨骺部分都有很大部分的密质骨成份。
2.2松质骨呈海绵状,弹性较大,结构疏松多孔,孔内含有骨髓。其位于骨的深部,由许多骨小梁构成。骨小梁呈针状或不规则的细杆状,均有若千层骨板平行排列组成。由骨板组成的骨小梁相互连接、搭成网架,网眼内充以骨髓、神经和血管等,所以,骨小梁的网眼实际上就是骨髓腔。大量相互连通的小型骨髓腔充分表现出骨小梁网在空间结构上的疏松特征。
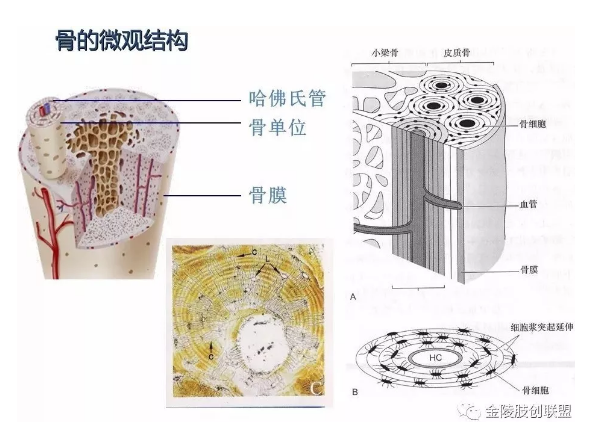
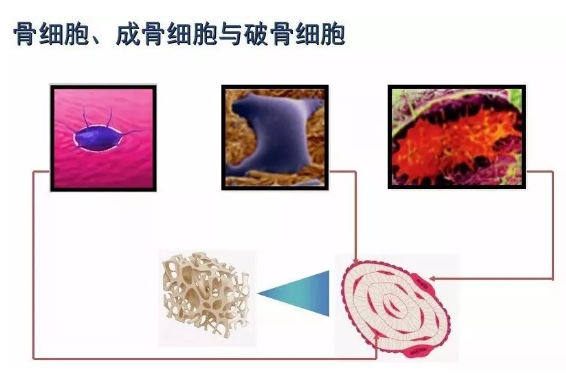
3.1骨细胞是扁椭圆形、多突起的细胞,单个分散排列于骨板内或骨板间,其胞质嗜碱性。骨细胞胞体位于骨陷窝内,突起位于骨小管内。相邻骨细胞的突起以缝隙连接相连,离子和小分子物质可通过此连接从一个骨细胞进入另一个骨细胞。骨小管也彼此相互沟通,骨陷窝和骨小管内含有组织液,可营养骨细胞和排出代谢产物。
3.2成骨细胞又称为骨母细胞,是形成骨组织的细胞,能合成和分泌骨基质,并参与骨的钙化,调节钙磷骨进出量。成骨细胞来源于骨祖细胞。成骨细胞常存在于新生骨的表面,呈单层排列。成骨细胞产生的类骨质填充于成骨细胞间逐渐将成骨细胞包埋,成骨细胞被埋入类骨质中转化为骨细胞。
3.3破骨细胞是专门从事骨吸收功能的一种细胞,故名破骨细胞。骨组织被侵蚀溶解称为骨组织重吸收,破骨细胞侵蚀溶解骨组织的作用称为破骨细胞性溶骨作用。破骨细胞分布着降钙素与甲状旁腺激素的受体,受甲状旁腺激素的响使破骨细胞数量增加,降钙素则抑制破骨细胞活动。
骨组织中的钙和磷不断更新,与机体的钙磷代谢密切相关,当机体需要时可以通过动员大量钙、磷离子入血或将血中过量的钙、磷离子贮存于骨,从而维持血钙的稳定。
二
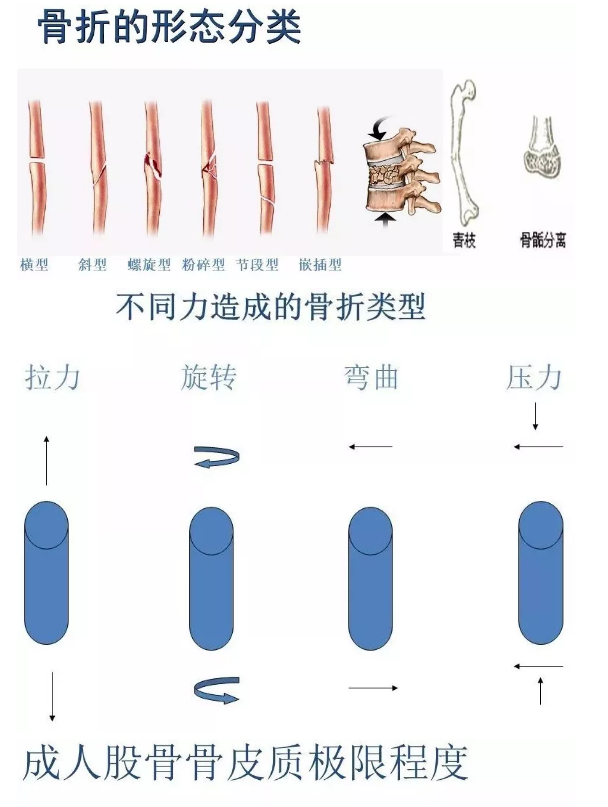
骨折的类型
外伤后导致骨的连续性和完整性受到破坏即为骨折。根据骨折移位情况,可以分为裂纹骨折、粉碎骨折、螺旋骨折、压缩骨折等类型。小儿多为青枝骨折,一般骨折错位不明显。临床表现为外伤以后立即出现疼痛、肿胀、活动障碍,若骨折错位,还可有局部畸形、异常活动和骨折摩擦音。严重者可损伤局部血管、神经、脏器等组织。
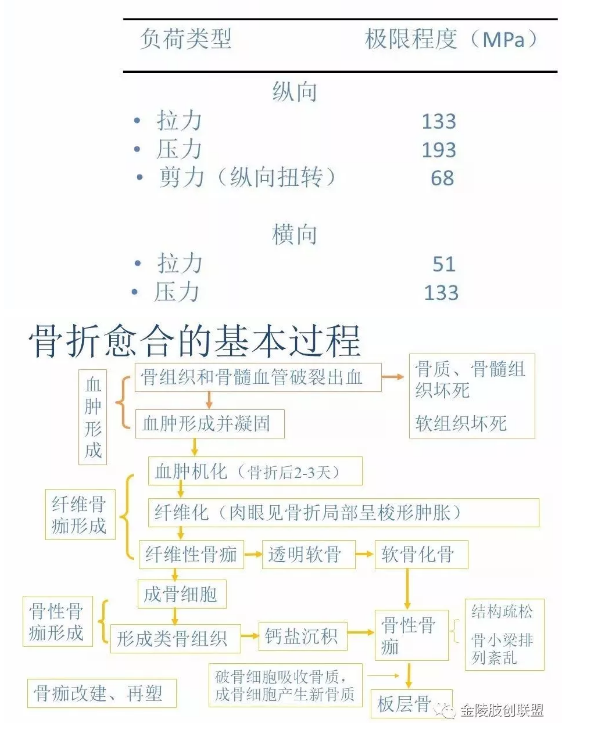
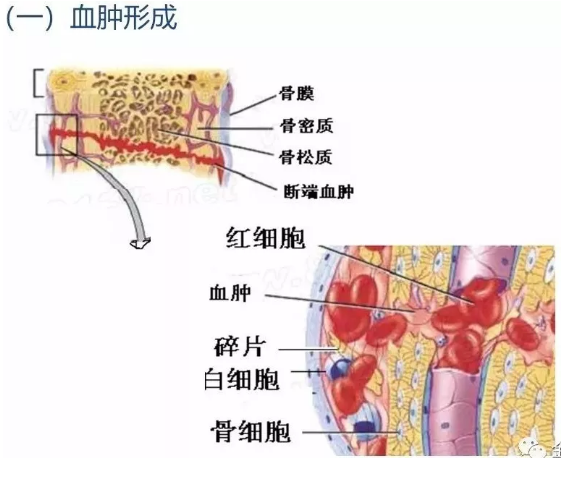
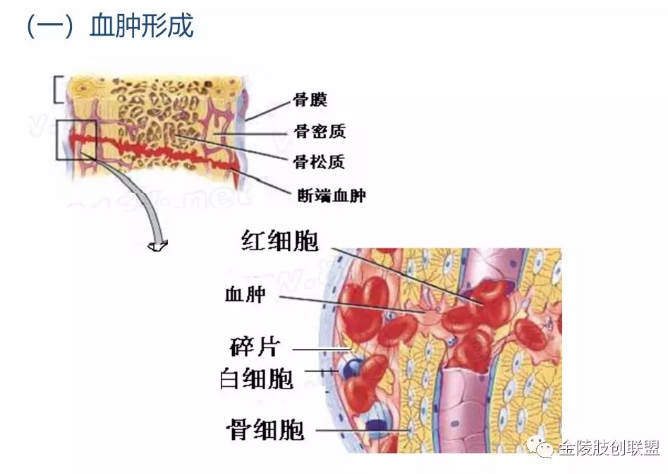
3.1血肿形成
骨折时除骨组织被破坏外,也一定伴有附近软组织的损伤或撕裂。骨组织和骨髓都富含血管,骨折后常伴有大量出血,填充在骨折的两断端及其周围组织间,形成血肿。骨折时由于骨折处营养骨髓、骨皮质及骨膜的血管随之发生断裂,因此在骨折发生的1~2天内,可见到骨髓造血细胞的坏死,骨髓内脂肪的析出,以后被异物巨细胞包绕形成脂肪“囊”。骨皮质亦可发生广泛性缺血性坏死,骨坏死在镜下表现为骨陷窝内的骨细胞消失而变为空穴。如果骨坏死范围不大,可被破骨细胞吸收,有时死骨可脱落、游离而形成死骨片。
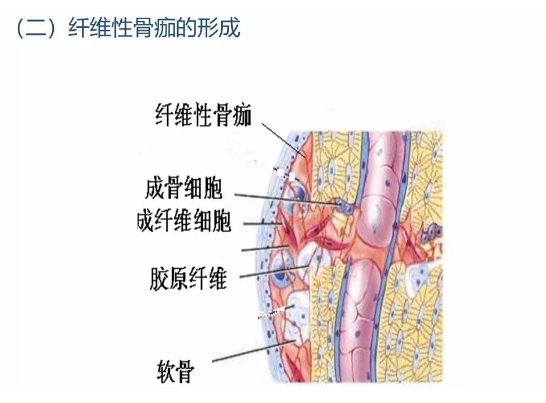
3.2 纤维骨痂形成
大约在骨折后的2~3天,从骨内膜及骨外膜增生的纤维母细胞及新生毛细血管侵入血肿,血肿开始机化。这些纤维母细胞实质上多数是软骨母细胞及骨母细胞的前身。上述增生的组织逐渐弥合,填充并桥接了骨折的断端,继而发生纤维化形成纤维性骨痂,或称暂时性骨痂肉眼上骨折局部呈梭形肿胀。约经1周左右,上述增生的肉芽组织及纤维组织部分可进一步分化,形成透明软骨。透明软骨的形成一般多见于骨外膜的骨痂区,而少见于骨髓内骨痂区,可能与前者血液供应较缺乏有关。此外,也与骨折断端的活动度及承受应力过大有关。但当骨痂内有过多的软骨形成时会延缓骨折的愈合时间。
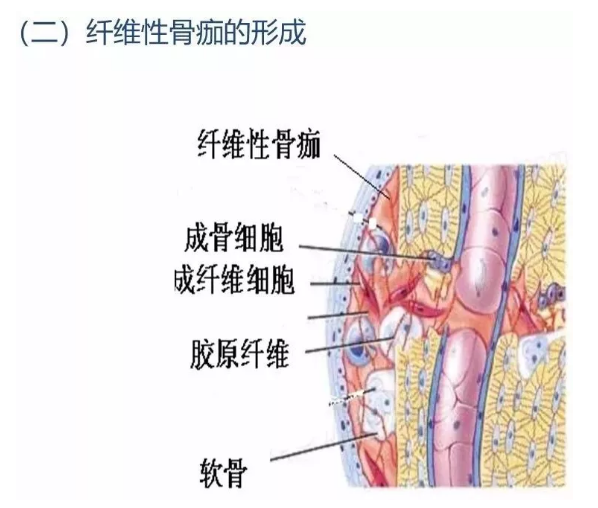
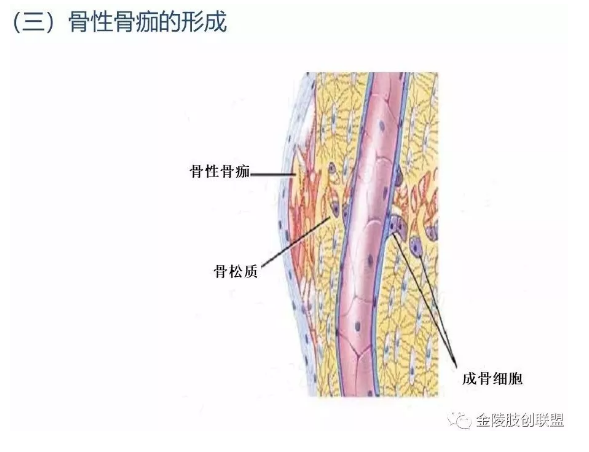
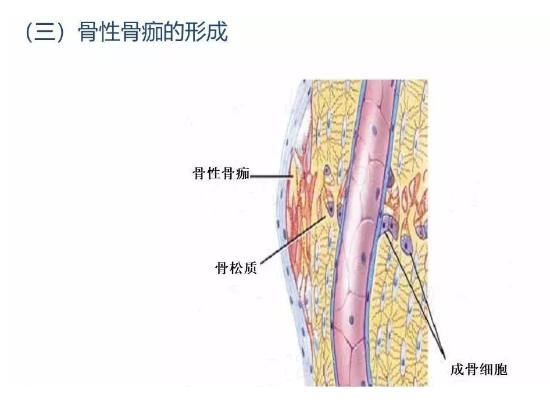
3.3 骨性骨痂形成
骨折愈合过程的进一步发展,是骨母细胞产生新生骨质逐渐取代上述纤维性骨痂。开始形成的骨质为类骨组织,以后发生钙盐沉着,形成编织骨,即骨性骨痂。纤维性骨痂内的软骨组织,和骨发育时的软骨化骨一样,发生钙盐沉着而演变为骨组织,参与骨性骨痂的形成。此时所形成的编织骨,由于其结构不够致密,骨小梁排列比较紊乱,故仍达不到正常功能需要。
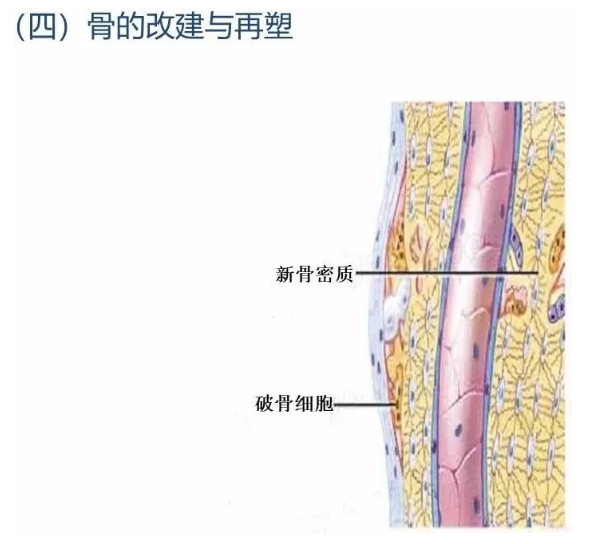
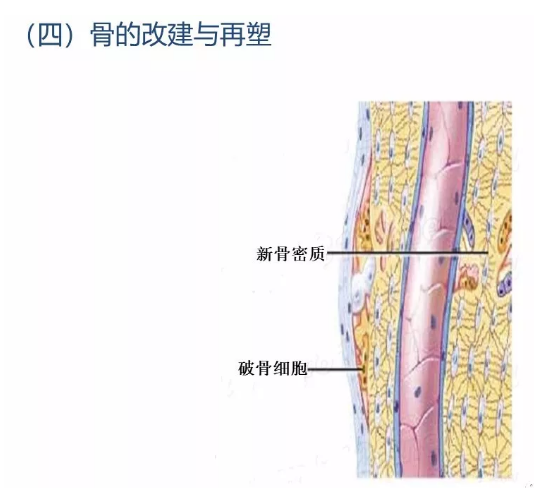
3.4 骨痂改建或再塑
上述骨痂建成后,骨折的断端仅被幼稚的、排列不规则的编织骨连接起来。为了符合人体生理要求而具有更牢固的结构和功能,编织骨进一步改建成为成熟的板层骨,皮质骨和髓腔的正常关系也重新恢复。改建是在破骨细胞的骨质吸收及骨母细胞新骨质形成的协调作用下进行的,即骨折骨所承受应力最大部位有更多的新骨形成而机械性功能不术需要的骨质则被吸收,这样就使骨折处上下两断端按原来的关系再连接起来,髓腔也再通。在一般情况下,经过上述步骤,骨折部恢复到与原来骨组织一样的结构,达到完全愈合。
三
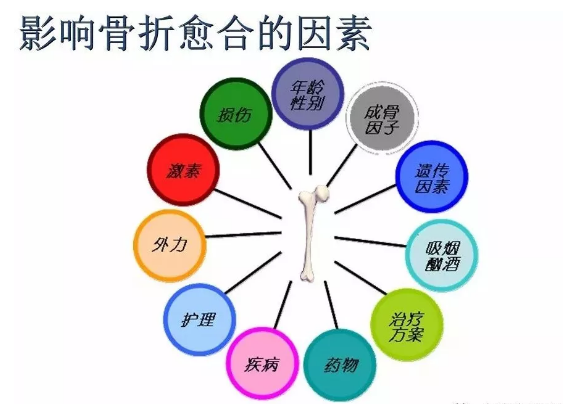
影响骨折愈合的因素
全身性因素
1、年龄:儿童骨组织再生能力强,故骨折愈合快;老年人骨再生能力较弱,故骨折愈合时间也较长。
2、营养:严重蛋白质缺乏和维生素C缺乏可影响骨基质的胶原合成;维生素D缺乏可影响骨痂钙化,妨碍骨折愈合。
3、疾病:例如-糖尿病、血管功能不全、骨质疏松症、贫血、激素缺乏等。
局部因素
1、局部血液供应:如果骨折部血液供应好则骨折愈合快,如肱骨的外科颈上端、骨折;反之,局部血液供应差者,骨折愈合慢,如股骨颈骨折。骨折类型也和血液供应有关:如螺旋形或斜形骨折,由于骨折部分与周围组织接触面大,因而有较大的毛细血管分布区域供应血液,愈合较横形骨折快。
2、骨折断端的状态:骨折断端对位不好或断端之间有软组织嵌塞等都会使愈合延缓甚至不能接合。此外,如果骨组织损伤过重如粉碎性骨折、,尤其骨膜破坏过多时,则骨的再生也较困难。骨折局部如出血过多,血肿巨大,不但影响断面的接触,且血肿机化时间的延长也影响骨折愈合。
3、骨折断端的固定:断端活动不仅可引起出血及软组织损伤,而且常常只形成纤维性骨痂而难有新骨形成。为了促进骨折愈合,良好的复位及固定是必要的。但长期固定可引起骨及肌肉的废用性萎缩,也会影响骨折愈合。
4、感染:开放性骨折即骨折处皮肤及软组织均断裂,骨折处暴露、时常合并化脓性感染,延缓骨折愈合。
为什么在骨折后,即便经过了治疗,也还是会出现骨折延迟愈合或骨不连?
我们把骨折后至少8个月骨折两端未能达到骨性连接的骨折,都称为骨不连,有很多骨折两端仅以软骨或纤维组织相连,只要它们不进一步骨化,且无骨小梁通过时,都属于骨不连。
四
生物学因素
生物学所致的骨延迟连接和骨不连接其治疗方法是得当的,骨延迟连接和骨不连接是由于生物学过程异常造成的,包括骨痂形成障碍、骨痂钙化障碍、区域性加速现象(reginal acceleratory phenomenon,RAP)低下、异常分化、骨改建异常、骨塑形异常和力学对骨塑形的影响。生物学因素可单独,也可与其他因素一起共同影响骨愈合。
在美国和加拿大,单独由于生物学因素所致的骨不连占骨不连的20%左右,合并技术性因素的另占20%左右。生物学因素所致的骨延迟连接和骨不连接大多发生在皮质骨,很少发生在松质骨。
1.1骨痂形成障碍:
对于长管骨骨折来说,如果骨痂形成量不足或根本不出现骨痂,说明局部多细胞介质活性产生异常,也说明正常骨愈合过程中的骨折初期细胞致敏-刺激-增殖-分化-机化等环节上出了障碍。在美国和加拿大,骨痂形成障碍占所有生物学因素的80%。临床表现为长骨骨折2月以上,X线摄片显示骨折端没有足够骨痂形成。组织病理学研究显示其骨折间隙很少有新的骨组织产生,而取代它们的是大量的纤维组织。临床上采用X线和细胞毒药物治疗肿瘤时可发生这种情况。此外,也可发生于局部神经阻断和非甾体消炎镇痛剂的应用。
1.2骨痂钙化障碍
骨痂钙化障碍可发生在各种类型的软骨病(但很少发生在抗维生素D型佝偻病),从而导致假性骨折和创伤性骨不连。一旦全身代谢障碍纠正,骨痂就能正常钙化,并可使骨愈合趋向正常。随后的骨改建和骨塑形必须等到骨痂完全钙化后开始。骨痂钙化障碍所致的骨延迟连接和骨不连接在美国只占骨延迟愈合和骨不连病因的3%以下。
1.3区域性加速现象(RAP)低下
区域性加速现象(RAP)低下:区域性加速现象——骨损伤后骨愈合的促进作用.它可使骨愈合的各个时期缩短,使骨愈合加速2-10倍。占生物学因素的75% 骨折3个月后临床X线清晰显示RAP低下,表现局部密质骨纵向隧道样改变缺失或邻近干骺端小梁稀少、骨质疏松。RAP低下 临床常见于糖尿病、骨折合并周围神经损伤 二磷酸中毒、严重放射性损伤和营养不良。
1.4 异常分化
异常分化是指尽管骨折早期局部组织细胞致敏-刺激-增殖反应是正常的,但如果这种早期产生的成骨细胞和成软骨细胞被成纤维细胞或成脂肪细胞替代,那么骨折端间隙将被瘢痕组织或脂肪组织所填充,而不是骨痂。临床上导致异常分化的常见原因包括某些转移性肿瘤和骨折不适当治疗;不常见的原因包括慢性原发性甲状旁腺机能亢进、神经纤维瘤病、糖尿病性神经病变、局部神经完全切除和先天性胫骨假关节。
1.5骨改建异常
现在已知骨改建是以基本多细胞单位(basic multicellular unit)为基础的,而基本多细胞单位是由许多类型的细胞、细胞间质和毛细血管在一定的时间和空间彼此连接在一起的特异机化组织。骨改建异常可导致板层骨取代骨痂的进程延缓。众所周知,骨痂不具有生物力学相关性结构特征,只有板层骨才具有这些特征。因此,骨改建延缓可导致负重骨痂变形和骨畸形愈合。其病因尚不清楚。一般认为骨改建异常与某些药物、生物化学和内分泌因素有关。
1.6.骨塑形异常
骨塑形异常大多发生在小儿的成骨不全,其板层骨替代编织骨或塑造骨的能力接近完全或完全丧失。骨塑形异常也可发生在软骨病和各种佝偻病,从而导致胫骨或股骨弯曲,这可能是由于新生板层骨钙化障碍,从而导致未钙化的板层骨基质堆积。
此外,也可能是由于骨改建过程中的“闸门-屏障作用”丧失,从而使堆积的未钙化板层骨基质修正受阻。众所周知,骨成熟后骨塑形能力就基本丧失,但成人骨折愈合后若干年X线片仍可显示内、外膜骨皮质表面的某些赋形作用。
五
局部因素
2.1骨折部位的血液循环差,如胫骨中下1/3段骨折,胫骨三段骨折,其中间段和远段,因髓内血管损伤,而血运差。股骨颈骨折.特别是头下骨折,其头端血运差,腕舟骨骨折其近端血运差,易发生骨不连。
2.2合并软组织损伤的范围广泛及程度严重的开放骨折,例如胫骨前面软组织撕脱损伤,由于骨折周围软组织损伤重,破坏了骨端的血运,也常导致骨不连。
2.3骨折处骨质缺损如火器伤骨折和严重粉碎性骨折,骨折处骨质丢失程度严重者、骨的连续性破坏,修复困难,易致骨不连。
2.4感染多发生于开放骨折(5%一7%)或手术后(1.2%一3.8%),感染使骨折端坏死及营养血管闭塞,导致骨不连。
2.5肌肉收缩力:可使骨折断端间隙增大,如尺骨鹰嘴骨折,膑骨骨折等。
2.6开放性粉碎性骨折:清创时过多地去除碎骨片造成骨缺损。
六
技术性因素
3.1粗暴或反复的闭合复位可损伤骨膜下血管和周围软组织,有时损伤稍大血管,造成新的创伤或加重骨折端的血液循环障碍,干扰骨折正常愈合修复过程。
3.2外固定不足、外固定范围不够例如小腿中段骨折时长腿石膏未超过股骨下2/3以上以及膝关节屈曲不超过20° 均可导致骨折处异常活动。
3.3未做到有监视早期合理功能锻炼,盲目提倡早期负重活动是目前骨折不愈合中的重要因素。
3.4未恢复骨折部位骨骼的稳定性即骨骼的连续性和力学完整性,采用切开复位内固定不仅要解剖复位,而且要求恢复骨折结构的完整性、连续性,避免有骨缺损或间隙尤其在压力侧,即使是小的粉碎骨片无法固定形成缺损也会在肢体活动中导致骨不连和内固定器材弯曲断裂、骨折不愈合。
3.5未能充分保护骨与软组织的血供。AO学派追求坚强固定的同时过多的破坏原有血运及局部软组织。
3.6未做到变坚强内固定为生物学固定,生物学固定即坚强内固定和弹性固定相结合。
3.7过度牵引:可使骨折端分离。
3.8固定不当:不能消除骨折端不利的异常活动及应力。
3.9骨折端对位不好:常有间隙存在或间隙中嵌有软组织。
医生最能影响的因素是力学环境,力学环境对骨折愈合的方式起重要作用,这也是进行骨折固定的基础。在血供良好的前提下,提供什么样的力学环境决定了会得到什么样的愈合方式。骨折治疗要注重:稳定性和血运供应,通过骨折部位力学环境的调节可以控制骨折愈合。
周强
副主任医师
空军运动医学学组委员;东部战区骨科专业委员会骨病肿瘤学组委员;中国残疾人康复协会肢体残疾协会青年委员;南京医学会骨科分会青年委员。
对各种严重的骨科创伤积累较丰富治疗经验,擅长脊柱、骨关节疾病的诊治。发表SCI论文一篇,国家核心期刊发表论文10篇,获军队医疗成果三等奖一项。