主动脉夹层(aortic dissection,AD)是一种严重的心血管急、危、重症,起病急,进展快,非常凶险,病死率极高。尽早诊断才能把握先机,获取挽救患者生命的可能性。2017年底发布的《主动脉夹层诊断与治疗规范中国专家共识》对主动脉夹层的分型、分期、临床表现、辅助检查和治疗流程进行了全面的总结。
共识指出,与发达国家相比,我国AD患者存在下述特点:(1)病因以高血压为主,青壮年多,高血压的知晓率和控制率比发达国家低;(2)患者的平均年龄较发达国家低10~20岁,预期寿命长。
AD发病主要和以下危险因素有关:①增加主动脉壁张力的各种因素,如高血压、主动脉缩窄、外伤等;②导致主动脉壁结构异常的因素,如动脉粥样硬化、遗传性结缔组织疾病(如Marfan综合征、Loeys-Dietz综合征、Ehlers-Danlos综合征等)、家族性遗传性AD或主动脉瘤、大动脉炎等;③其他因素如妊娠、医源性AD等。
国内多中心研究表明,高血压、Marfan综合征、吸烟、饮酒、主动脉瓣二叶畸形(BAV)、动脉粥样硬化等是国人AD发病的主要独立危险因素。文献报道国人AD患者高血压发生率为50.1%~75.9%。
急性AD患者死亡的主要原因是主动脉破裂、急性心脏填塞、急性心肌梗死、卒中、腹腔脏器缺血、肢体缺血等。
1.DeBakey分型
I型:原发破口位于升主动脉或主动脉弓,夹层累及大部或全部胸升主动脉、主动脉弓、胸降主动脉、腹主动脉;
II型:原发破口位于升主动脉,夹层累及升主动脉,少数可累及主动脉弓;
III型:原发破口位于左锁骨下动脉以远,夹层范围局限于胸降主动脉为IIIa型,向下同时累及腹主动脉为IIIb型。
2.Stanford分型
夹层累及升主动脉者为Stanford A型,相当于DeBakey I型和Ⅱ型;夹层仅累及胸降主动脉及其远端为Stanford B型,相当于DeBakeyⅢ型。
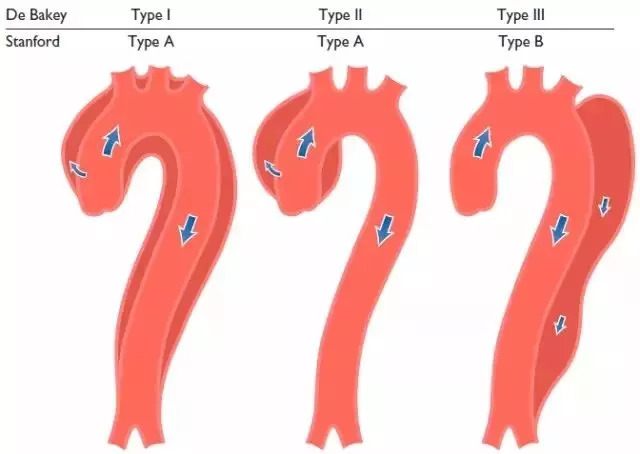
图1 Stanford分型和DeBakey分型
3.孙氏细化分型
北京安贞医院孙立忠教授团队根据我国AD的发病特征,在Stanford分型的基础上提出了AD细化分型(亦称孙氏分型)。
(1)Stanford A型主动脉夹层的孙氏细化分型
根据主动脉根部受累情况细分为3个亚型:
A1型,窦管交界和其近端正常,无主动脉瓣关闭不全;
A2型,主动脉窦部直径小于3.5cm,夹层累及右冠状动脉,致其开口处内膜部分剥离或全部撕脱,轻至中度主动脉瓣关闭不全;
A3型根部重度受累型,窦部直径大于5.0cm,或直径为3.5~5.0cm但窦管交界结构破坏,有严重主动脉瓣关闭不全。
根据病因及弓部病变情况分为C型(复杂型)和S型(简单型):
符合以下任意一项者为C型:①原发内膜破口在弓部或其远端,夹层逆行剥离至升主动脉或近端主动脉弓;②弓部或其远端有动脉瘤形成(直径大于5.0cm);③头臂动脉有夹层或动脉瘤形成;④TEVAR术后逆撕A型AD;⑤套筒样内膜剥脱和广泛壁内血肿:⑥主动脉根部或升主动脉术后残余夹层或新发夹层;⑦病因为遗传性结缔组织病,如Marfan综合征。
S型:原发内膜破口位于升主动脉且不合并上述任何一种C型病变。临床诊断时根据实际情况组合分型,如A1C型。
图2 Stanford A型主动脉夹层的孙氏细化分型
(2)Stanford B型AD的孙氏细化分型
根降主动脉的扩张部位分为3个亚型:
B1型:降主动脉无扩张或仅近端扩张,中、远端直径接近正常;
B2型:全胸降主动脉扩张,腹主动脉直径接近正常;
B3型:全胸降主动脉、腹主动脉均扩张。
根据病因及弓部有无夹层累及亦分为C型和S型:
符合以下任意一项者为C型:①夹层累及左锁骨下动脉开口或远端主动脉弓;②合并心脏疾病,如瓣膜病、冠心病等;③合并近端主动脉病变,如主动脉根部瘤、升主动脉或主动脉弓部瘤等;④病因为遗传性结缔组织疾病,如 Marfan综合征。
S型:不合并上述任何一种情况者。
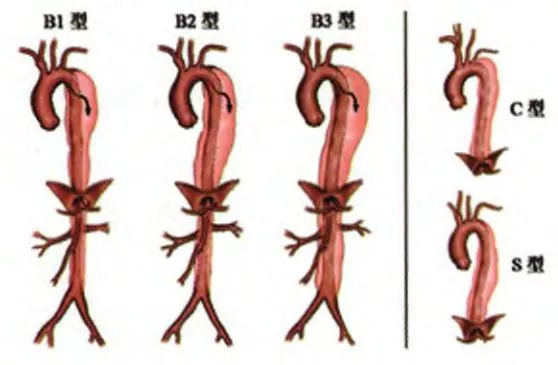
图3 Stanford B型主动脉夹层的孙氏细化分型
1.疼痛
疼痛是AD患者最为普遍的主诉。AD导致的疼痛常被描述为“撕裂样”或“刀割样”持续性难以忍受的锐痛。部分患者亦可无疼痛症状。
疼痛的部位和性质可提示AD破口的部位及进展情况。Stanford A型夹层常表现为前胸痛或背痛,Stanford B型夹层常表现为背痛或腹痛,但两者疼痛部位可存在交叉。
对于剧烈胸背痛且伴高危病史及体征者应怀疑AD的可能;出现迁移性疼痛可能提示夹层进展,如患者出现下肢疼痛,则提示夹层可能累及髂动脉或股动脉。
2.心脏并发症
心脏是Stanford A型AD最常受累的器官。AD可导致心脏正常解剖结构破坏或心脏活动受限从而引起相关症状:
(1)夹层导致主动脉根部扩张、主动脉瓣对合不良等可引起主动脉瓣关闭不全,轻者无明显临床表现,重者可出现心力衰竭甚至心源性休克。
(2)夹层累及冠状动脉开口可导致急性心肌梗死、心功能衰竭或恶性心律失常,患者可表现为典型的冠状动脉综合征,如胸痛、胸闷和呼吸困难,心电图ST段抬高和T波改变。
(3)夹层假腔渗漏或夹层破入心包可引起心包积液或心包压塞,发生率约为17.7%。
(4)急性主动脉瓣关闭不全、急性心缺血或梗死及心包压塞常表现为心力衰竭。
3.其他脏器灌注不良表现
AD累及主动脉的其他重要分支血管可导致脏器缺血或灌注不良的临床表现:
(1)夹层累及无名动脉或左颈总动脉可导致中枢神经系统症状,3%~6%的患者发生脑血管意外,患者表现为晕厥或意识障碍;夹层影响脊髓动脉灌注时,脊髓局部缺血或坏死可导致下肢轻瘫或截瘫。
(2)夹层累及一侧或双侧肾动脉可有血尿、无尿、严重高血压甚至肾功能衰竭。
(3)夹层累及腹腔干、肠系膜上及肠系膜下动脉时可引起胃肠道缺血表现,如急腹症和肠坏死,部分患者表现为黑便或血便;有时腹腔动脉受累引起肝脏或脾脏梗死。
(4)夹层累及下肢动脉时可出现急性下肢缺血症状,如疼痛、无脉甚至下肢缺血坏死等。
4.AD的体征
疑似AD的患者出现以下体征有助于临床诊断:
(1)血压异常:AD常可引起远端肢体血流减少,导致四肢血压差别较大。若测量的肢体是夹层受累一侧,将会误诊为低血压,从而导致误诊和错误治疗。因此对于AD患者,应常规测量四肢血压。50.1%~75.9%的AD患者合并高血压,但也有部分患者就诊时表现为低血压,此时应考虑心脏填塞的可能。
(2)主动脉瓣区舒张期杂音且患者既往无心脏病史,则提示夹层所致急性主动脉瓣反流可能。
(3)胸部体征:AD大量渗出或者破裂出血时,可出现气管向右侧偏移,左胸叩诊呈浊音,左侧呼吸音减弱;双肺湿啰音提示急性左心衰。
(4)腹部体征:AD导致腹腔脏器供血障碍时,可造成肠麻痹甚至坏死,表现为腹部膨隆,叩诊呈鼓音,广泛压痛、反跳痛及肌紧张。
(5)神经系统体征:脑供血障碍时出现淡漠嗜睡、昏迷或偏瘫;脊髓供血障碍时,可有下肢肌力减弱甚至截瘫。
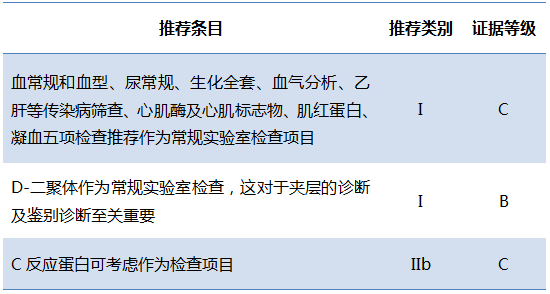
1.实验室检查
胸痛且高度怀疑急性AD的患者,应完善常规检查如血常规及血型、尿常规、肝肾功、血气分析、血糖、传染病筛查、心肌酶、肌红蛋白、凝血5项(包括D-二聚体)和血脂检查。这些检查有助于鉴别诊断及评估脏器功能及手术风险,减少术前准备的时间。
表1 疑诊主动脉夹层患者实验室检查项目的推荐
患者D-二聚体快速升高时,拟诊为AD的可能性增大。研究表明,发病24 h内,当D-二聚体达到临界值500 μg/L时,其诊断急性AD的敏感性为100%,特异性为67%,故可作为急性AD诊断的排除指标。但D-二聚体阴性也不能除外主动脉溃疡或壁间血肿可能。
2.影像学检查
AD的影像学检查目的是要对全主动脉进行综合评价,包括AD受累的范围、形态、不同部位主动脉的直径、主动脉瓣及各分支受累情况、与周围组织的关系,以及AD的其他相关表现如心包积液、胸腔积液及脏器缺血情况等。
表2 疑诊主动脉夹层患者影像学检查的推荐

对于急性胸痛的患者,2010 AHA指南中提出了疑诊AD的高危易感因素、胸痛特征和体征。
表3 主动脉夹层的高危病史、症状及体征
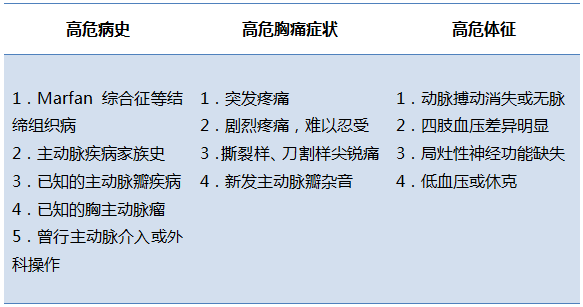
IRAD研究基于上述高危因素提出AD危险评分,根据患者符合危险因素分类(高危易感因素、高危疼痛特征及高危体征)的类别数计0~3分(0分为低危,1分为中危,≥2分为高危);该评分≥1分诊断AD的敏感度达95.7%。因此,对存在上述高危病史、症状及体征的初诊患者,应考虑AD可能并安排合理的辅助检查以明确诊断。
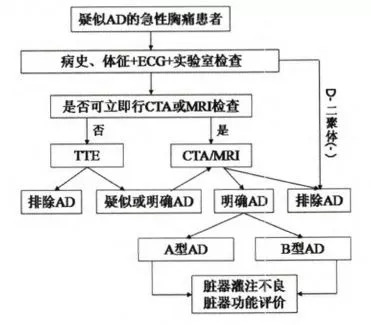
图4 主动脉夹层的诊断流程
AD初步治疗的原则是有效镇痛、控制心率和血压,减轻主动脉剪应力,降低主动脉破裂的风险。
1.镇痛
适当肌注或静脉应用阿片类药物(吗啡、哌替啶)可降低交感神经兴奋导致的心率和血压的上升,提高控制心率和血压的效果。
2.控制心率和血压
静脉应用β受体阻滞剂(如美托洛尔、艾司洛尔等)是最基础的药物治疗方法,但应保证能维持最低的有效终末器官灌注。对于降压效果不佳者,可在β受体阻滞剂的基础上联用一种或多种降压药物。
AD患者降压药物的选择、用药方案及注意事项详见相关指南。药物治疗的目标为控制收缩压至100~120 mmHg、心率60~80次/min。
需注意的是,若患者心率未得到良好控制,不要首选硝普钠降压。因硝普钠可引起反射性儿茶酚胺释放,使左心室收缩力和主动脉壁切应力增加,加重夹层病情。
进一步治疗方案应根据AD的类型、合并症、疾病进展等因素综合考虑。
说明
本文作者:孙立忠. 主动脉夹层诊断与治疗规范中国专家共识. 中华胸心血管外科杂志. 2017, 33(11): 641-654.
本文来源:医脉通心血管