中华医学会眼科学分会眼底病学组 中国医师协会眼科医师分会眼底病专委会 《玻璃体切割手术治疗2型糖尿病视网膜病变专家共识》专家组
通信作者:黎晓新,北京大学人民医院眼科中心,北京 100044/厦门大学附属厦门眼科中心,厦门 361003,Email:dr_lixiaoxin@163.com;许迅,上海交通大学医学院附属第一人民医院眼科 国家眼部疾病临床医学研究中心,上海 200080,Email:drxuxun@sjtu.edu.cn
引用本文: 中华医学会眼科学分会眼底病学组, 中国医师协会眼科医师分会眼底病专委会, 《玻璃体切割手术治疗2型糖尿病视网膜病变专家共识》专家组. 玻璃体切割手术治疗2型糖尿病视网膜病变专家共识[J]. 中华眼底病杂志, 2024, 40(9): 663-686. DOI: 10.3760/cma.j.cn511434-20240729-00286.
摘 要
增生型糖尿病视网膜病变(PDR)是糖尿病视网膜病变(DR)的晚期表现,常伴有玻璃体积血和视网膜脱离,严重影响患者的视力,甚至导致严重视力损伤。虽然玻璃体切割手术是治疗PDR的有效方法,但手术操作具有一定的难度,不当处理可能会对患者手术后的视力恢复产生不利影响或引起并发症。因此,明确PDR的手术适应证和规范操作流程至关重要。为此,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专委会以及《玻璃体切割手术治疗2型糖尿病视网膜病变专家共识》专家组,针对9个关键临床问题,基于最新的循证医学证据,并结合国际指南和我国的社会经济发展现状,就DR手术时机的选择、围手术期血糖管理、手术方式的选择、手术操作方案的制定、药物联合或激光治疗等方面提出了推荐意见,形成了我国《玻璃体切割手术治疗2型糖尿病视网膜病变专家共识》。本共识适用于中国眼底病专科医师和从事眼底病专业的医师,旨在为PDR患者的玻璃体手术治疗提供科学指导,辅助临床决策制定,进一步提高我国DR的手术治疗水平。
正 文
糖尿病视网膜病变(DR)是由糖尿病引发的视网膜微血管损害,可导致一系列病变及全视网膜非血管组织的损伤,是一种可能严重影响视力乃至致盲的慢性疾病[1]。中华医学会眼科学分会眼底病学组为规范DR的管理,分别在2014年和2022年发布了临床诊疗指南,涵盖了DR的定义、诊断、分期、治疗等多方面的内容,并强调了预防、筛查、转诊、干预以及患者的整体管理。《我国糖尿病视网膜病变临床诊疗指南(2022年)——基于循证医学修订》[2]特别关注了DR的激光和药物治疗,但对于较为严重的增生型DR(PDR)的手术治疗原则和具体操作方法未作详述。PDR标志着视网膜微血管病变已进入严重阶段,对视力的影响极大,是糖尿病患者寻求眼科治疗的主要原因之一,可能导致不可逆的视力损害。PDR可以分为以下三个阶段:(1)增生早期:出现视网膜新生血管(NVE)或视盘新生血管(NVD)。当NVD覆盖超过1/4~1/3的视盘面积(DA),或NVE覆盖超过1/2 DA,或伴有视网膜前出血或玻璃体积血(VH)时,被称为“高危PDR”。(2)纤维增生期:形成纤维膜,可能伴有视网膜前出血或VH。(3)增生晚期:出现牵拉性视网膜脱离(TRD),伴有纤维膜,可能合并或不合并VH,还包括虹膜和房角的新生血管[2-3]。在VH的情况下,深层的纤维血管膜和视网膜脱离往往难以直接观察到,这增加了手术难度,不当处理可能会降低手术后视力恢复的效果,甚至引起并发症。因此,需要明确手术时机、围手术期血糖控制、手术计划、手术技术选择、纤维血管膜处理方法、联合药物或激光治疗的应用,以及玻璃体填充物的选择等关键点。鉴于此,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专委会联合组织了相关领域的专家,共同制定了《玻璃体切割手术治疗2型糖尿病视网膜病变专家共识》,旨在为我国的眼底病专科医生提供更具体的临床指导。
1 共识编写方法
1.1 制定共识的理论依据和方法学
本共识严格按照循证医学指南原则制定,制定过程中参考了证据评价与推荐意见分级、制定和评价(GRADE)系统的理念和原则。共识专家组成员的遴选和组成、利益冲突管理、外部审查和组织批准均根据中华医学会眼科学分会的政策和程序进行。
1.2 共识使用者和目标人群
本共识的适用范围为DR玻璃体切割手术(PPV)治疗的手术时机、围手术期血糖管理、手术方式选择、手术操作方案的制定等。其目标人群为中国眼底病专科医师和从事眼底病专业的医师。
1.3 共识专家组构成
共识专家组主要的临床专家成员由中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专委会委员以及全国各省市具有多年玻璃体视网膜手术经验、具有临床影响力的医生组成。
1.4 利益冲突说明
共识专家组成员(包括临床专家和方法学专家)的利益冲突管理依据世界卫生组织以及国际指南联盟对利益冲突管理的指导原则执行。共识专家组向中华医学会眼科学分会报告了个人潜在的利益冲突(包含财务和专业相关的利益冲突)。所有成员均无实质性利益冲突。
1.5 临床问题遴选和确定
方法学团队与临床专家对PPV治疗DR相关的临床问题进行了探讨。经过对最初临床问题的多轮修改和讨论,最终确定了在本共识中要明确的9个临床问题。
1.6 证据检索及整合
共识的方法学团队邀请中国临床实践指南联盟与临床专家合作,针对共识中的每一个临床问题进行系统性证据检索。检索数据库包括 PubMed、EMBASE和Cochrane Library,时间跨度为数据库建立至2023年11月1日。检索策略采用关键词及关键词结合自由词的方式,在数据库的题目和摘要中进行检索。检索词包括 “proliferative diabetic retinopathy”、“diabetic macular oedema” 以及“vitrectomy”等(表1)。

除电子数据库检索外,共识专家组成员提供的关键研究以及已发表的系统评价中纳入的研究也被作为补充资料。针对每一个临床问题制定具体的纳入和排除标准,并设计数据提取表格。在每个临床问题上,优先纳入系统评价;当系统评价无法回答关注的临床问题时,则纳入随机对照试验(RCT)。当RCT证据缺乏、间接性或证据体质量极低时,补充纳入非随机对照研究或其他观察性研究证据。
两名系统评价员独立进行文献筛查及数据提取;遇到分歧时,由第三名系统评价员协助解决。使用 RevMan 5.3 软件,采用随机效应模型进行荟萃分析。对于二分类结局,效应值采用比值比(OR)及其95%可信区间(CI);对于连续性结局,效应值采用均值差(MD)及其95%CI。在进行荟萃分析之前,充分考虑研究间的临床异质性和方法学异质性。统计学异质性通过χ2检验和I2统计量评价。当χ2检验P<0.1且I2>50%时,认为存在统计学异质性。当研究间存在统计学异质性时,探索潜在的异质性来源,并根据异质性来源进行亚组分析。搜集到的证据主要围绕2型糖尿病。
1.7 证据分级与推荐意见形成
采用《牛津循证医学中心分级2011版》作为主要工具对本共识中的循证医学证据进行等级评估(表2),同时也参考了GRADE系统。在评估证据等级时,考虑了偏倚风险、不一致性、间接性、不精确性和发表偏倚等因素,并据此对证据等级进行了相应的调整。
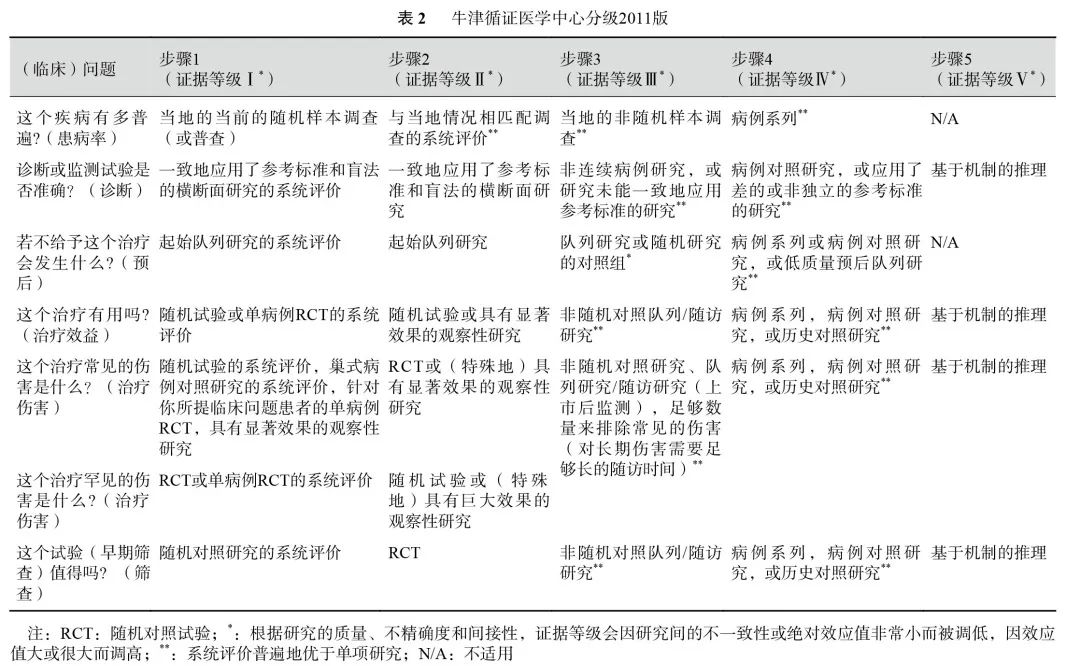
对于推荐意见的形成,共识专家组参考了GRADE系统中的要素,包括医学干预的利弊平衡、证据质量、价值观念与偏好、成本与资源耗费,以及可及性等因素,制定了推荐的方向和强度的标准。最终将推荐强度分为三个等级:强推荐、中等推荐和弱推荐(表3)。强推荐:共识临床专家组对该推荐意见反映的最佳临床实践有高度的信心,建议目标用户均采纳该推荐意见。中等推荐:共识临床专家组对该推荐意见反映的最佳临床实践有中等程度的信心,多数目标用户应采纳该推荐意见,但在执行过程中应注意考虑医患共同决策。弱推荐:共识临床专家组对该推荐意见有一定的信心,但应有条件地应用于目标群体,强调医患共同决策的重要性。
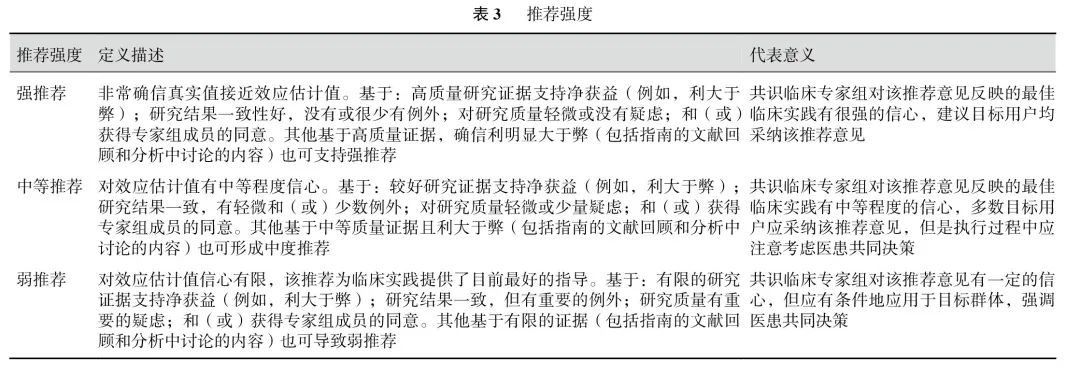
共识专家组通过对研究证据进行公开讨论后,以投票的形式达成了对推荐意见的共识。当专家组意见不一致时,则采用德尔菲问卷调查的方法[4]进行相应的修改和第二轮投票,直到达成共识。
1.8 共识的传播和实施
共识发布后,将主要通过以下方式进行传播和推广:(1)专业期刊、网站和学术会议:将在相关专业期刊上发表,并通过官方网站和学术会议进行介绍。(2)共识推广专场:有计划地在我国部分地区组织共识推广专场活动,确保临床医师及其他利益相关群体能够充分了解并正确应用该共识。这些措施旨在确保共识的内容能够广泛传播,并在实际临床实践中得到有效应用。
2 PDR的PPV治疗原则和操作相关问题
问题1:2型糖尿病导致的PDR患者发生VH后,应在多长时间后考虑进行PPV?(鉴于1型糖尿病的发生率较低,相关文献数量有限,纳入的研究中2型糖尿病人群占比较大,因此对于此问题的证据总结主要针对2型糖尿病导致的PDR患者)
推荐意见:基于目前有限的证据,对于存在VH或合并血管纤维增生引起的视网膜牵拉及TRD的2型糖尿病PDR患者,建议积血早期进行PPV治疗(中等推荐)。
两项研究结果显示,对于存在VH但尚未出现视网膜脱离的PDR患者,若在积血后的30 d内接受PPV治疗,能够显著缩短患者低视力的持续时间,并且手术后1~2年的视力预后较好[5-6]。
一项回顾性队列研究[5](证据等级Ⅲ)探讨了PDR合并VH患者接受PPV的最佳时机。该研究纳入了因PDR并发VH的患者,排除了并发视网膜脱离、既往有影响视力的其他视网膜病变或黄斑病变、各种类型青光眼以及随访时间少于24个月的患者。最终纳入了符合标准的PDR合并VH患者67例70只眼,其中1型糖尿病患者4例5只眼(7.1%,5/70),2型糖尿病患者63例65只眼(92.9%,65/70)。患者按VH的时间分为三组:病程<1个月组22只眼,平均年龄45.23岁;病程1~3个月组23只眼,平均年龄45.78岁;病程>3个月组25只眼,平均年龄50.48岁。所有患者手术后均随访24~42个月。末次随访时,视力达到0.5及以上者的比例分别为:病程<1个月组41%、病程1~3个月组23%、病程>3个月组0%。病程<1个月组与其他两组之间的差异均有统计学意义(P=0.03、P<0.001)。
另一项回顾性队列研究[6](证据等级Ⅲ)比较了立即手术组(患者在积血30 d内接受了PPV治疗)与延迟手术组(患者在积血30 d后接受了PPV治疗)的视力改善情况。手术后12个月末次随访时,两组患者的视力均较基线显著改善(P=0.002、P<0.000 1),但两组患者间视力无显著差异(P=0.684)。考虑延迟手术组患者手术前视力状况较差,即视力较差和(或)低水平视力维持时间较长,在随访终点时,立即手术组和延迟手术组的手术后视力曲线下面积无显著性差异(P>0.05)。这表明,在积血30 d内接受PPV治疗能够显著减少患者低视力的持续时间。
问题2:围手术期的PDR患者目标血糖范围是多少?如何有效控制其围手术期血糖?( 由于目前尚无仅针对眼科手术的血糖管理指南/专家共识,故参考多个包含全身手术在内的围手术期血糖管理指南/专家共识进行总结)
推荐意见一:建议PDR患者PPV前血糖尽可能控制在6.0~10.0 mmol/L之间,为预防低血糖,血糖允许值可放宽至13.9 mmol/L。如果有必要,可进行动态血糖监测。对于高龄患者或伴有多种合并症的患者,为避免低血糖,建议血糖最高允许值为13.9 mmol/L,血糖监测频率为0.5~2.0 h一次。对于择期手术患者,如果随机血糖水平≥10.0 mmol/L,则手术后建议每半小时监测一次血糖,直至血糖恢复至正常或降至 10.0 mmol/L 以下;如果血糖难以控制,应与其他相关科室进行会诊,并与患者充分沟通可能的风险。对于不可择期(增生晚期)的手术患者,建议更密切地监测血糖,以避免低血糖(低于 3.9 mmol/L)和酮中毒的发生(中等推荐)。
Cheisson等[7]研究(证据等级 V)指出,在进行眼科手术前,血糖范围应控制在 6.6 ~10.0 mmol/L之间;血糖低于3.9 mmol/L时被认为是低血糖状态,手术前应予以避免。2018 年《中国临床实践围手术期血糖管理指南》[8](证据等级 V)建议,手术中血糖控制目标为 6.7~11.1 mmol/L,手术后血糖控制目标为<12.0 mmol/L;而对于 PDR 患者,手术后血糖不应超过 10.0 mmol/L。在建议的目标血糖范围内,手术中应每1.0~2.0小时监测一次血糖,手术后应每4.0~ 6.0小时监测一次血糖。对于可择期手术患者,如果随机血糖≥12.0 mmol/L或糖化血红蛋白≥9%,建议推迟手术时间。对于急诊手术中出现酮症酸中毒或高渗性昏迷的患者,如果患者的病情允许,建议在手术前首先纠正代谢紊乱、pH 值和渗透压,直到恢复正常。中华医学会麻醉学分会于 2016 年发布的《围术期血糖管理专家共识》[9](证据等级 V)指出,围手术期血糖应控制在 7.8~10.0 mmol/L之间;对于高龄、有严重合并症、频繁发作低血糖的患者,目标血糖范围可适当放宽至不超过 13.9 mmol/L(表4)。对于正常饮食的患者,围手术期应监测空腹血糖和三餐后的血糖;对于血糖高的患者,每 1.0~2.0小时监测一次血糖。

推荐意见二:建议对计划接受PPV治疗的 PDR 患者进行全面的手术前血糖水平评估及糖尿病相关并发症检查。对于那些伴有严重糖尿病并发症(如糖尿病酮症酸中毒、糖尿病肾病、糖尿病周围神经病变、糖尿病心血管疾病等)的PDR患者,以及在围手术期出现明显且频繁血糖波动的患者,建议咨询内分泌科专家和其他相关并发症的专业专家进行联合管理(中等推荐)。
《中国临床实践围手术期血糖管理指南》[8]指出,对于血糖波动较大或血糖水平不符合标准的围手术期患者,建议咨询内分泌科医生并采取积极治疗措施(证据等级 V)。对于肾功能正常的患者,手术前无需停用二甲双胍治疗(证据等级 V)。然而,对于肾功能异常且手术中需要全身麻醉的患者,应在手术前48 h停止使用二甲双胍,并在手术后 48~72 h内继续停用,直到肾功能恢复正常(证据等级 V)。若围手术期随机血糖两次以上超过10 mmol/L,应请内分泌科会诊,并通过降糖药物或胰岛素控制血糖(证据等级 V)。在低血糖的情况下,手术中输液和胰岛素的剂量应根据血糖水平来确定。中华医学会麻醉学分会 2016 年发布的《围术期血糖管理专家共识》[9]指出:当围手术期血糖大于10.0 mmol/L时,应启动胰岛素治疗(证据等级 V);对于正在接受静脉输注胰岛素的患者,当血糖降至5.6 mmol/L以下时,应重新评估治疗方案(证据等级 V);如果围手术期血糖降至3.9 mmol/L或更低,应立即停用胰岛素,并开始升血糖处理(证据等级 V)。
问题3:对于需要手术治疗的PDR患者,是否推荐围手术期联合注射抗血管内皮生长因子(anti-VEGF)药物?
推荐意见:PPV治疗前 14 d内或手术完毕即刻注射anti-VEGF 药物均可提高PDR患者的手术后视力,降低中央视网膜厚度,并有助于防止手术后近期的VH。因此,推荐PDR患者行PPV治疗时,在围手术期注射anti-VEGF药物(中等推荐)。
共有22 项RCT( 1 396 只眼)比较了PPV前联合注射anti-VEGF药物与单纯PPV治疗 PDR 的临床有效性[10-30](表5)。
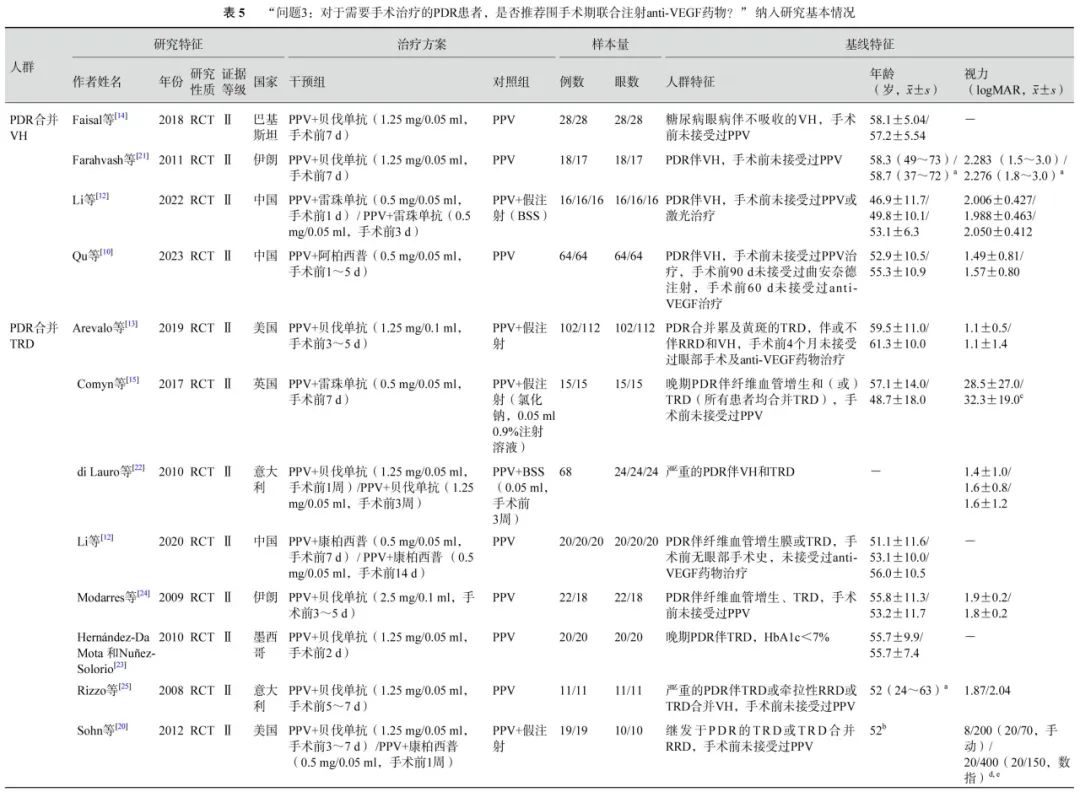
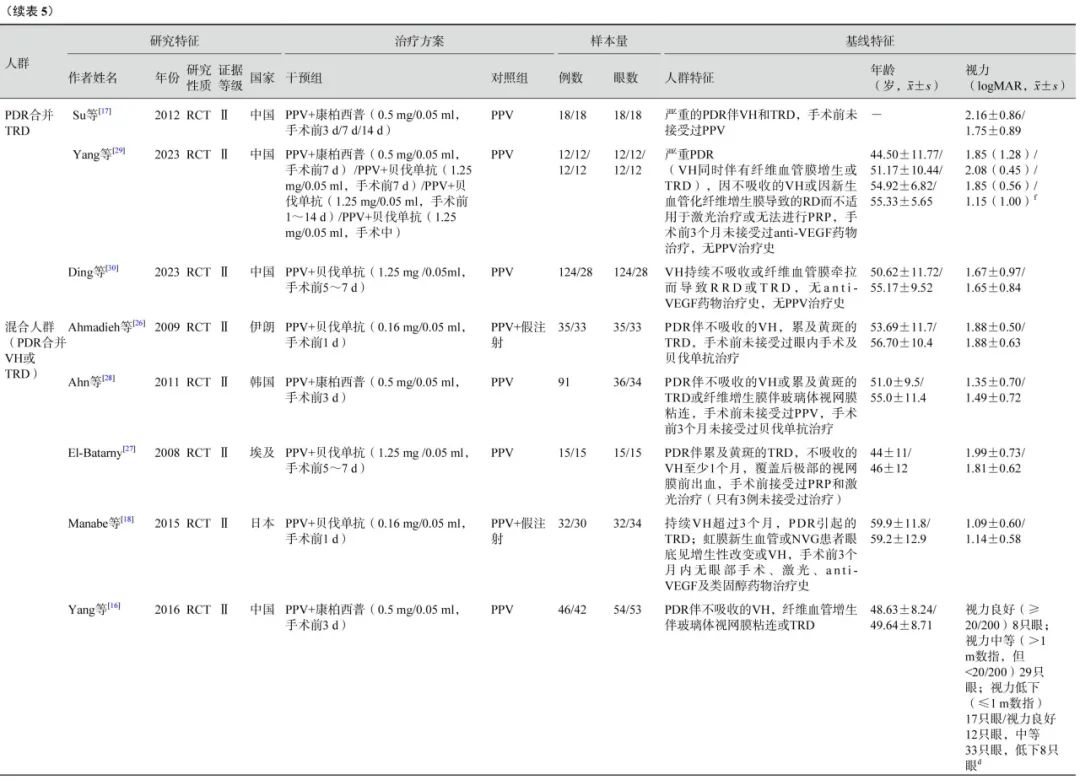
在PDR合并VH的人群中,荟萃分析(证据等级Ⅰ)结果显示,与单纯PPV相比,手术前联合anti-VEGF药物治疗的患者具有以下优势:手术中VH发生率较低(2 项研究[11, 14],OR=0.04,95%CI 0.01~0.13,P<0.000 01);医源性视网膜裂孔发生率较低(2 项研究[11, 14],OR=0.14,95%CI 0.04~0.52,P=0.003);电凝使用率较低(1 项研究[11],OR=0.05,95%CI 0.01~0.30,P=0.000 9);硅油填充率较低(1项研究[11],OR=0.11,95%CI 0.03~0.47,P=0.003)(图1);手术时间较短(2 项研究[11, 14],MD=-16.84 min,95%CI -21.79~-11.89,P<0.000 01)(图2)。RCT证据(证据等级Ⅱ)显示,与单纯PPV相比,手术前联合anti-VEGF药物治疗者,其手术后 1 周及1 、3 个月的VH发生率明显更低(1 项研究[10],P= 0.021、 0.006、0.047);手术后 3 个月视力改善程度更好(1 项研究[11],P=0.04);两者之间手术后视网膜脱离发生率无显著差异(1 项研究[21],P=0.97)。
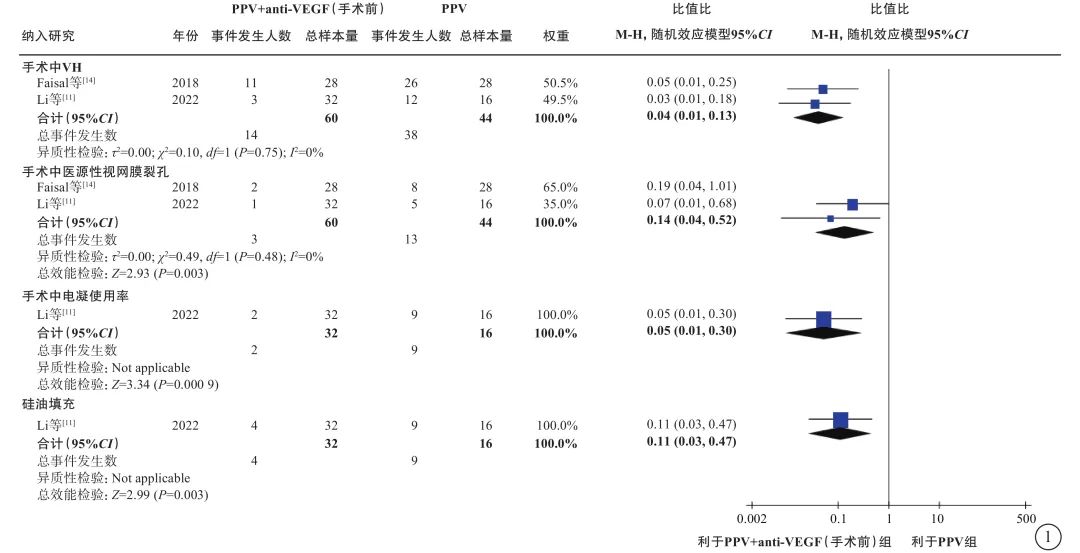
图1 PDR合并VH患者PPV联合或不联合手术前anti-VEGF药物治疗手术中情况比较 PDR:增生型糖尿病视网膜病变;VH:玻璃体积血;PPV:玻璃体切割手术;anti-VEGF:抗血管内皮生长因子;CI:可信区间;Not applicable:不适用
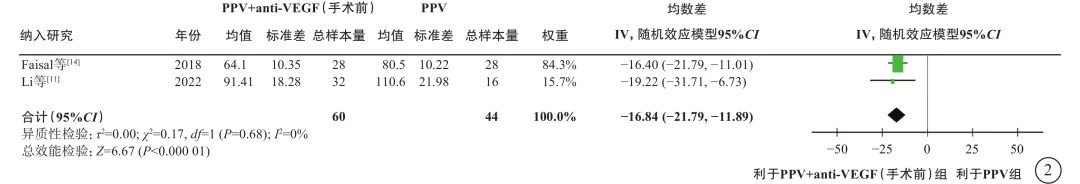
图2 PDR合并VH患者PPV联合或不联合手术前anti-VEGF药物治疗手术时间比较 PDR:增生型糖尿病视网膜病变;VH:玻璃体积血;PPV:玻璃体切割手术;anti-VEGF:抗血管内皮生长因子;CI:可信区间
在PDR合并TRD伴或不伴VH的人群中,荟萃分析(证据等级Ⅰ)结果显示,与单纯PPV相比,手术前联合anti-VEGF药物治疗者,手术中VH发生率较低(9 项研究[12-13, 16-17, 22-23, 26-27, 29],OR=0.18,95%CI 0.09~0.35,P<0.000 1);电凝使用率较低(3 项研究[13, 17, 22],OR=0.19,95%CI 0.05~0.79,P=0.02);硅油填充率较低(9项研究[13, 15, 17-18, 22, 24, 27, 29-30],OR=0.38,95%CI 0.17~0.87,P=0.02);气体填充率(2项研究[29-30],OR=0.91,95%CI 0.42~1.94,P=0.80)和医源性视网膜裂孔发生率(3 项研究[18, 26-27],OR=0.82,95%CI 0.31~2.13,P=0.68)在两组间无统计学差异(图3);手术时间较短(12项研究[12-13, 15, 17-18, 22-25, 27, 29-30],MD=-17.11 min,95%CI -23.87~-10.34,P<0.000 01)(图4);手术后视网膜脱离发生率较低(3项研究[13, 23, 27],OR=0.40,95%CI 0.17~0.94,P=0.04)(图5);手术后早期出血(4 周及 4 周内复发)发生率较低(8 项研究[13, 16, 18-19, 27-28, 29-30],OR=0.32,95%CI 0.20~0.51,P<0.000 01)(图5);手术后晚期出血发生率(4 周以上复发)在两组间无显著差异(5项研究[16-17, 19, 28, 30],OR=0.51,95%CI 0.25~1.05,P=0.07)(图5);手术后视力改善程度较好(5项研究[15, 17, 20, 24, 30],MD=-0.29,95%CI -0.56~-0.03,P=0.03)(图6)。
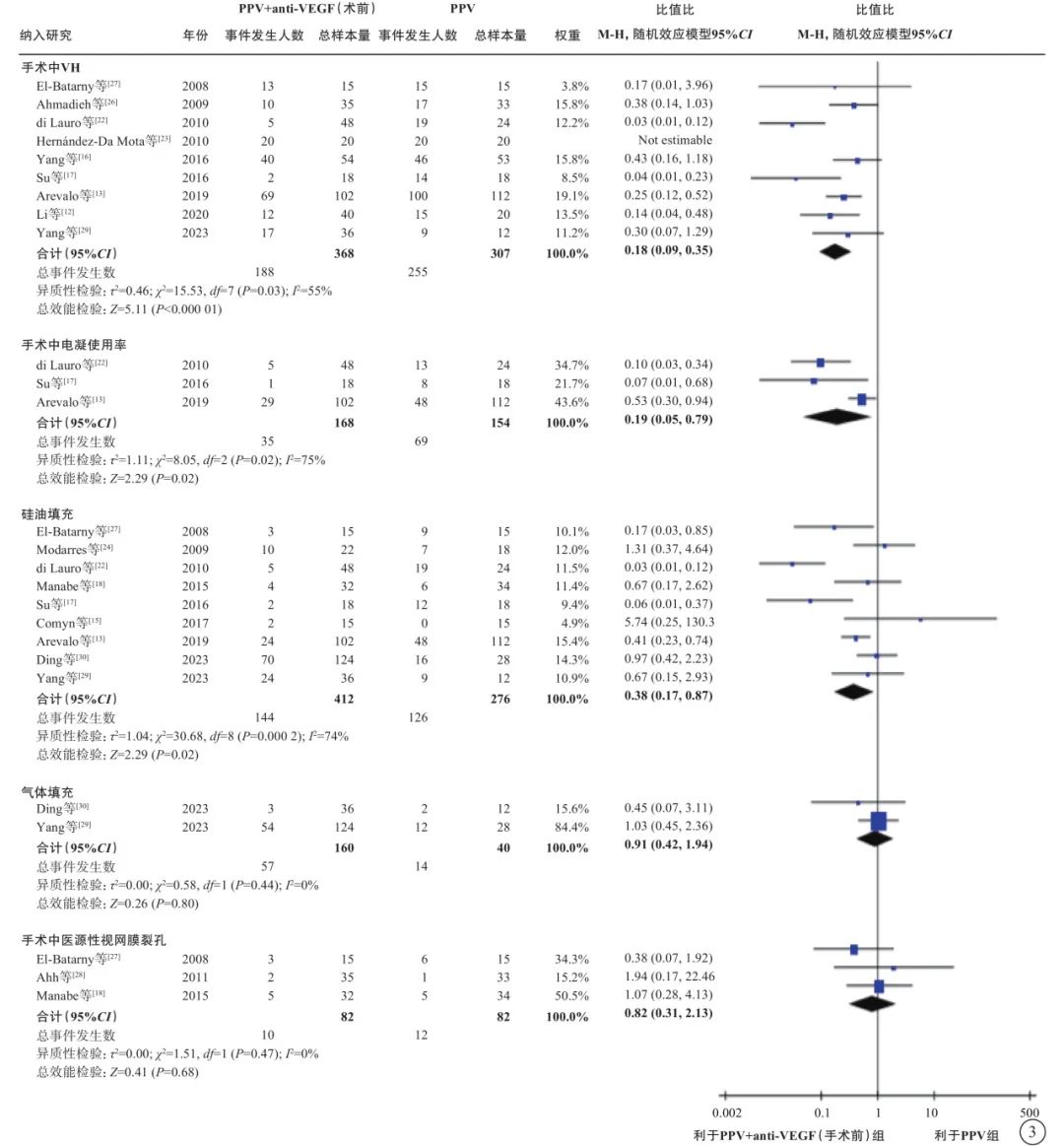
图3 PDR合并TRD伴或不伴VH患者PPV联合或不联合手术前anti-VEGF药物治疗手术中情况比较 PDR:增生型糖尿病视网膜病变;TRD:牵拉性视网膜脱离;VH:玻璃体积血;PPV:玻璃体切割手术;anti-VEGF:抗血管内皮生长因子;CI:可信区间;Not estimable:不可估
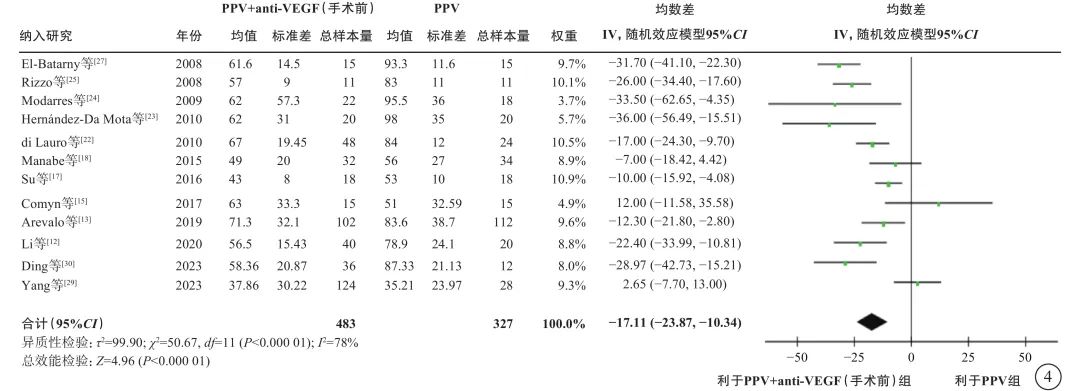
图4 PDR合并TRD伴或不伴VH患者PPV联合或不联合手术前anti-VEGF药物治疗手术时间比较 PDR:增生型糖尿病视网膜病变;TRD:牵拉性视网膜脱离;VH:玻璃体积血;PPV:玻璃体切割手术;anti-VEGF:抗血管内皮生长因子;CI:可信区间
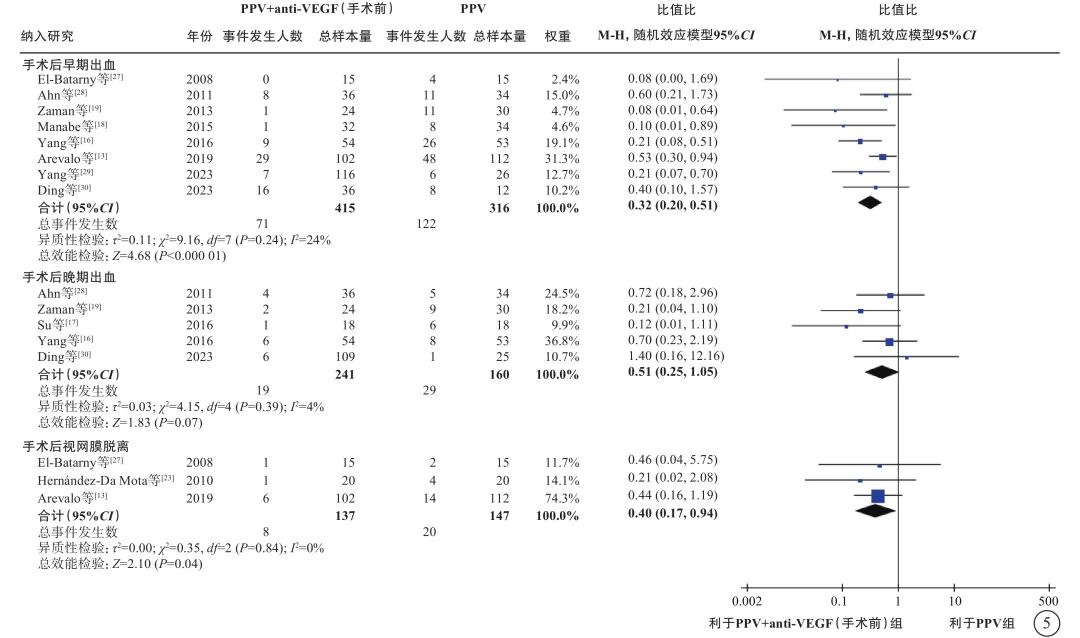
图5 PDR合并TRD伴或不伴VH患者PPV联合或不联合手术前anti-VEGF药物治疗手术后结果比较 PDR:增生型糖尿病视网膜病变;TRD:牵拉性视网膜脱离;VH:玻璃体积血;PPV:玻璃体切割手术;anti-VEGF:抗血管内皮生长因子;CI:可信区间;早期出血:手术后4周及4周内VH复发;晚期出血:手术后4周后VH复发
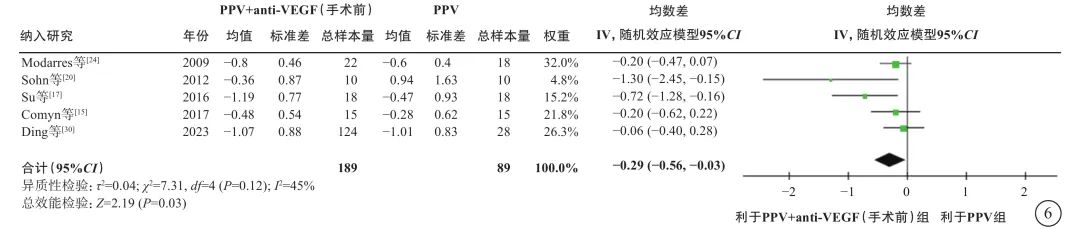
图6 PDR合并TRD伴或不伴VH患者PPV联合或不联合手术前anti-VEGF药物治疗后视力变化值(logMAR单位)比较 PDR:增生型糖尿病视网膜病变;TRD:牵拉性视网膜脱离;VH:玻璃体积血;PPV:玻璃体切割手术;anti-VEGF:抗血管内皮生长因子;logMAR:最小分辨角对数;CI:可信区间
三项RCT和一项网状荟萃分析比较了PPV完毕时联合anti-VEGF药物与单纯PPV治疗PDR的临床有效性。一项网状荟萃分析[31](证据等级Ⅰ)纳入了26 项RCT 原始研究,包括1 802例需接受PPV治疗的PDR伴TRD或不可吸收VH患者,比较了手术前1~5 d、手术前6~14 d、手术前>14 d及手术完毕时注射anti-VEGF 药物的临床结局。结果表明,手术前注射anti-VEGF药物与手术完毕时注射anti-VEGF药物在最佳矫正视力(BCVA)、手术后VH复发率和手术中出血发生率方面均无显著差异。一项 RCT[32](证据等级Ⅱ)纳入了 84例严重PDR患者(84 只眼),所有患者均表现为不吸收的VH和不伴TRD的纤维血管增生。该研究将患者随机分为两组,试验组于手术前 3~5 d和手术完毕时均接受anti-VEGF药物注射;对照组仅手术前3~5 d接受anti-VEGF药物注射。手术后1个月,试验组VH发生率较低(9.3% vs. 19.5%,P=0.046),BCVA[以最小分辨角对数(logMAR)视力记录]较好(0.57±0.11 vs. 0.71±0.15,P=0.019);但手术后 3 、 6 个月,两组间VH发生率和BCVA的差异均无统计学意义。手术后1、3个月,试验组中央视网膜厚度更薄,但手术后 6 个月两组之间无差异。总体而言,与仅在PPV前联合注射anti-VEGF药物相比,手术完毕时联合注射anti-VEGF 药物对严重PDR患者手术后早期(1 个月)的VH、视力提升及手术后 3 个月内视网膜水肿具有较好的改善作用。另外两项RCT(证据等级Ⅱ)亦显示,相较于不注射anti-VEGF药物,手术完毕时即刻注射anti-VEGF 药物可显著降低手术后24周或1年内患者的中央视网膜厚度[33-34],显著提高患者24周内的BCVA,并降低VH复发率[34]。
问题4:对于需要接受PPV治疗的PDR患者,是否推荐其手术前行全视网膜激光光凝(PRP)治疗?
推荐意见:与anti-VEGF药物治疗相比,PDR患者在PPV前接受PRP治疗并不会显著改善其视力。在决定是否进行PRP治疗时,应依据荧光素眼底血管造影和(或)光相干断层扫描血管成像(OCTA)对视网膜缺血状况的评估结果。对于视网膜缺血症状不断发展,且OCTA检测显示存在大面积无灌注区的患者,可以考虑在手术前增加PRP治疗。然而,需要特别注意的是,对于合并TRD的患者,手术前行PRP治疗可能会增加视网膜裂孔的风险,因此在进行此类治疗时需谨慎权衡(中等推荐)。
自从anti-VEGF药物上市以来,多个研究比较了PDR患者接受anti-VEGF药物与PRP治疗的获益。一项RCT[35-36](Diabetic Retinopathy Clinical Research Network Protocol S研究,证据等级Ⅱ)纳入了305例PDR患者394只眼,比较了单纯anti-VEGF药物与PRP治疗后视力获益的差异。结果显示,治疗后2年,anti-VEGF药物治疗组和PRP组视力字母评分较基线分别改善2.8、0.2(非劣效P<0.001);治疗后5年,anti-VEGF药物治疗组和PRP组视力字母评分较基线分别改善3.1±14.3、3.0±10.5(P=0.68)[36-37],但anti-VEGF药物治疗组视野敏感性变化优于PRP组。另一项RCT[38-39](证据等级Ⅱ)表明,治疗后12个月,anti-VEGF药物治疗组和PRP组视力字母评分较基线分别改善1.6和-3.9(P=0.049 5)。这说明,PDR患者PRP治疗后视力差于anti-VEGF药物。
一项队列研究[37, 40](证据等级Ⅲ)纳入106例PDR患者130只眼,比较了PPV联合手术前PRP(60例67只眼)与单纯PPV(46例63只眼)治疗后6个月患者的视力变化情况(以logMAR为单位),并进行了长达1年的随访。结果显示,手术前联合PRP治疗组在手术后6个月时视力从基线1.47±0.16提升为0.69±0.09 (P<0.000 1),而单纯PPV治疗组手术后6个月时视力从基线0.91±0.18提升至0.69±0.14(P=0.121)。结果表明,与单纯PPV相比,PPV联合手术前PRP治疗可改善患者手术后视力,但差异无统计学意义。
问题5:PPV中处理PDR患者的纤维血管膜时,选择膜分割还是膜清除技术?
推荐意见:在处理PDR患者的纤维血管膜时,应以确保手术安全性为首要原则,尽量将膜清除干净。膜分割技术,即保留部分膜的方法,已被证明能够改善患者的视力,并且造成裂孔的风险相对较小。这种方法同样适用于那些新生血管膜上存在较多粗大血管的患者。对于手术经验相对较少的医生,可以从膜分割技术开始尝试,并逐渐向膜清除技术过渡,以积累经验和提高手术技巧(中等推荐)。
纤维血管膜是PDR患者VH的主要病理基础,其有效清除在手术治疗中占据核心地位。在PPV过程中,针对纤维血管膜的清除策略包括经典的Enbloc技术及其改良形式,即膜分割(membrane segmentation)与膜清除(delamination)技术[39-41]。Enbloc技术作为一种综合性手段,强调在初始阶段即进行精细的视网膜膜分割,随后实施PPV以彻底清除膜组织[39]。而膜分割与膜清除作为改良Enbloc技术(modified Enbloc excision technique)的核心要素,为复杂膜性病变的处理提供了更为精细与灵活的操作方案[40]。膜清除技术通常在玻璃体切除的主体部分完成后实施,利用高转速玻璃体切割头、精密眼内剪刀或双手协同的剥膜技术,实现对膜组织的直接、高效清除[41]。膜分割技术是在清除大部分玻璃体切除后将整片膜分割成数片孤立的小片机化膜,随后逐一进行安全去除或根据具体情况选择保留部分小片膜[42]。这一策略尤其适用于膜与视网膜紧密粘连、难以直接剥离的复杂情况,通过分割技术可以有效减轻牵拉力量,减少视网膜损伤的风险。在PPV中应用膜分割技术,不仅能够有效缓解增生膜对视网膜的牵拉作用,保护视网膜结构的完整性,还能显著降低手术过程中医源性视网膜裂孔的发生率。此外,该技术还有助于减少因硅油或气体填充等后续治疗措施可能引发的并发症,提高手术的整体安全性与疗效[42-43]。
1994年Han等[40]、1997年Meier和Wiedemann[44]以及2002年Kakehashi[45]发表的三项病例系列研究(证据等级Ⅳ),均提供了强有力的证据表明,与传统Enbloc技术相比,改良Enbloc技术在治疗PDR患者时,能够达到相似的视力改善效果,且伴随着更高的视网膜复位率。尤为值得注意的是,这一技术革新显著缩短了手术时长,同时并未增加手术并发症的发生率,体现了其在提升治疗效率与安全性方面的双重优势[40, 44-45]。
2004年黎晓新等[41]开展的一项回顾性队列研究(证据等级Ⅲ)纳入276例伴有纤维血管膜的PDR患者(296只眼),对比分析膜分割(106例110只眼)与膜清除(170例186只眼)这两种手术方法的治疗效果。结果显示,与膜清除组相比,膜分割组在减少医源性视网膜裂孔的发生率上展现出了显著优势(35.5% vs. 54.3%,P<0.01);此外,尽管膜分割组手术后视网膜再出血发生率(25.5%)略低于膜清除组(28.0%),但差异无统计学意义(P>0.05)。值得注意的是,两组患者在手术后的视力改善上并未表现出显著差异,这一结果表明,无论是膜分割还是膜清除,均能有效促进患者视力的恢复。这提示,在进行PDR手术时,初学者可以从膜分割技术入手,因其相对较低的医源性视网膜裂孔风险,有助于在安全的前提下逐步掌握手术技巧,为患者带来更佳的治疗效果。
2021年郑传珍等[46]的病例系列研究(证据等级Ⅳ)探讨了膜分割技术在治疗伴有VH及TRD的严重PDR患者中的手术后效果。其联合了手术前3 d玻璃体腔注射anti-VEGF药物治疗,并秉持“最小量化”PPV理念,采用27G玻璃体切割系统完成标准三通道PPV。手术中,研究团队运用膜分割技术,以解除视网膜牵拉为主要目标,而非盲目追求增生膜的彻底清除。通过(18.8±9.7)(6~33)个月的随访观察,该研究发现,患者BCVA(以logMAR视力记录)较手术前显著提升,从手术前的1.90(1.30,2.30)逐步提升至手术后1周的1.00(0.70,1.90)、手术后1个月的0.80(0.50,1.30),而手术后3、6个月均稳定在0.70(0.40,1.20)(各时间点P值均<0.01),彰显了视力恢复的显著性与持续性。此外,首次随访时视网膜复位率92.5%,至末次随访时提升至96.2%。该研究表明,PPV中应用膜分割技术不仅可解除增生膜对视网膜的牵拉,还能减少医源性视网膜裂孔的发生。
问题6:PDR患者行PPV治疗时如何选择填充物?
推荐意见:建议对于患有PDR且在手术前已存在视网膜裂孔,或手术过程中产生医源性视网膜裂孔或视网膜切开的患者,在进行PPV时使用长效气体(如20%SF6、16%C2F6或14%C3F8[47-49])或硅油进行眼内填充。而对于没有视网膜裂孔的PDR患者,在充分解除牵拉因素后,可以保留使用常规的眼内灌注液。对于合并有虹膜新生血管的少数患者,仍然可以选择硅油填充。对于使用长效气体或硅油填充的患者,手术后应严密监测眼压(中等推荐)。
一项回顾性队列研究[50](证据等级Ⅲ)纳入了接受PPV治疗的PDR合并VH患者73例73只眼,其中18只眼(24.7%)手术中未使用填充物,18只眼(24.7%)采用空气填充,15只眼(20.5%)采用C3F8气体填充,22只眼(30.1%)采用硅油填充,并以此分为四组。手术后1个月随访时,无填充组视力改善显著优于C3F8气体填充组;但手术后6个月随访时,无填充组、空气填充组、C3F8气体填充组三组患者间视力改善程度无明显差异。四组手术后分别有11.1%、11.1%、6.7%和9.5%的患者出现复发性VH,但其VH复发率差异无统计学意义。手术后6个月随访时,无填充组、空气填充组、C3F8气体填充组和硅油填充组患者视力分别较基线改善0.98、0.94、0.97、0.19 logMAR单位。除硅油填充组患者视力改善幅度较小(仅为36%)外,其余三组患者视力改善幅度达67%~89%。该研究表明,PPV治疗PDR合并VH时采用眼内填充物并不能减少手术后VH发生率,对未合并视网膜裂孔的PDR患者可以不使用眼内填充物。
一项回顾性病例系列研究[42](证据等级Ⅳ)纳入PDR合并TRD患者42例50只眼,在PPV中采用膜分割技术去除增生膜。手术中12只眼发生医源性视网膜裂孔,给予气体或硅油填充;未发生医源性视网膜裂孔的患眼给予灌注液填充。手术后随访9.7(3~29)个月,患者平均BCVA由手术前0.03±0.25提高到手术后0.17±0.78,68.0%的患眼视力提高,24.0%的患眼视力不变,8.0%的患眼视力下降。一次手术后视网膜复位率为84.0%,其中灌注液填充组(未发生医源性视网膜裂孔)患眼复位率为89.5%;气体或硅油填充组(发生医源性视网膜裂孔)随访期间患眼复位率为66.7%,随访期结束时最终视网膜复位率为96.0%(2只眼放弃治疗)。手术后34.0%(17/50)的患眼发生VH,其中3只眼VH自行吸收,余下14只眼给予anti-VEGF药物和(或)玻璃体腔灌洗手术治疗后积血吸收。发生并发症的49只眼中,灌注液、气体、硅油填充分别为28、11、10 只眼。该研究表明,对于未发生医源性视网膜裂孔的患者可以不进行气体或硅油填充。
一项回顾性队列研究[51](证据等级Ⅲ)纳入年龄50.44(20~82)岁的接受PPV治疗的PDR患者451例536只眼,其中282只眼保留灌注液,138只眼填充气体(包括空气、SF6、C2F6和C3F8),116只眼填充硅油,随访时间15.2(2~53)个月,探索PPV后使用不同眼内填充物的治疗效果。该研究发现,手术前或手术中是否合并视网膜裂孔是PDR患者手术中选择眼内填充物的重要因素。对于手术中发现视网膜裂孔或手术中造成医源性视网膜裂孔、视网膜切开的患者,一般采用硅油或膨胀性气体填充;不存在视网膜裂孔的患者,在有效解除牵拉因素的基础上,保留灌注液填充;对于少数合并虹膜新生血管等情况仍可选择硅油填充。
一项RCT[52](证据等级Ⅱ)纳入302例伴有TRD或纤维增生膜的PDR患者,手术中随机接受硅油填充123只眼,14%~16% C3F8填充135只眼。其观察发现,填充C3F8的患者手术后6个月时视力较好(logMAR视力中位数0.24,95%CI 0.02~0.46,P<0.05),两组患者手术中视网膜裂孔的发生率相当,手术时间、手术中及手术后并发症等观察指标的差异均无统计学意义。该研究认为,对于伴有TRD或纤维增生膜的PDR患者,应当考虑选择C3F8为一线填充物。当发生视网膜裂孔时,对于单眼患者或伴有新生血管性青光眼、眼球痨(phthisis bulbi)的高风险、无法解除玻璃体视网膜牵拉或视网膜无法解剖复位的情况下,硅油仍是填充物的一线选择。
问题7:对于糖尿病黄斑水肿(DME),是否推荐PPV治疗?
推荐意见:推荐存在牵拉因素的DME(T-DME)患者行PPV治疗。对于非牵拉的难治性DME患者(激光光凝无效、anti-VEGF药物治疗无效以及抗炎治疗效果不好),可选择PPV治疗(中等推荐)。
对于T-DME患者,PPV作为一线治疗已被写入多个指南和共识中[2, 53-54]。中华医学会眼科学分会眼底病学组2023年发布的《我国糖尿病视网膜病变临床诊疗指南(2022年)——基于循证医学修订》[2] 中明确指出,对于因玻璃体视网膜交界面异常引起的DME, 通过PPV解除玻璃体界面的牵拉,是有效缓解黄斑水肿的一种方法;对于非手术治疗效果不佳的持续性DME患者,PPV联合内界膜剥除能有效改善黄斑水肿(证据等级Ⅱ)。欧洲视网膜病专家组在《糖尿病黄斑水肿治疗指南(2017年)》[53]中也指出,对存在玻璃体视网膜牵拉的患者,PPV的优势显而易见,尤其是存在前后纵向牵拉的DME患者。英国共识工作组2020年更新的《糖尿病视网膜病变和糖尿病黄斑水肿治疗路径管理》[54]指出,应用PPV治疗T-DME可有效改善黄斑的解剖结构异常,可以预防视网膜脱离等严重并发症的发生。
非牵拉的持续不吸收的黄斑水肿也可以考虑PPV,但需注意存在视力下降的风险[2]。Raizada等[55]在2015年的一项RCT(证据等级Ⅱ)中纳入了44例(44只眼)激光光凝治疗无效的非牵拉性DME(nT-DME)患者,其中22例(22只眼)接受了3次anti-VEGF药物治疗(anti-VEGF组),22例(22只眼)接受了PPV联合内界膜剥除手术治疗(PPV组),平均随访5.81个月。结果显示,治疗后120 d,PPV组有59.1%(13只眼)视力改善,18.2%(4只眼)视力无变化,22.7%(5只眼)视力下降,手术后视力相对手术前基线改善明显(P=0.028);治疗前后的平均视力差异为0.189 logMAR单位(95%CI 0.021~0.356)。anti-VEGF组有72.8%(16只眼)视力改善,13.6%(3只眼)视力无变化,13.6%(3只眼)视力下降;治疗后视力相对基线改善明显(P=0.018 1),治疗前后的平均视力差异为0.203 logMAR单位(95%CI 0.036~0.369)。PPV组患者中央视网膜厚度由手术前410.1 μm显著降至手术后248.8 μm(P<0.000 1),治疗前后降幅平均值为161.4 μm(95%CI 3.28~219.45);anti-VEGF组由基线432.7 μm显著降至治疗后324.3 μm(P<0.000 1),治疗前后降幅平均值为108.5 μm(95%CI 62.20~154.71)。但值得注意的是,PPV组与anti-VEGF组患者视力改善程度、中央视网膜厚度治疗前后的降幅平均值比较,差异无统计学意义(P>0.05)。这说明,对于激光光凝治疗无效的nT-DME患者,PPV治疗后4个月中央视网膜厚度较手术前明显下降,手术后视力较手术前明显提升,但与单纯anti-VEGF药物3次治疗相比,中央视网膜厚度和视力改善程度无显著差异。
问题8:伴或不伴黄斑前膜(ERM)的DME患者行PPV治疗时,是否联合内界膜剥除?
推荐意见:伴有ERM的DME患者行PPV治疗,剥除ERM时是否同时剥除内界膜没有明确结论,不形成推荐意见。如不伴有ERM,只伴有内界膜增厚,则推荐PPV时剥除内界膜。
6项研究[56-61](包括2项RCT和4项观察性研究,801只眼)探讨了nT-DME患者行PPV治疗时,是否需同时剥除内界膜(表6)。通过荟萃分析(证据等级Ⅲ)对比PPV联合内界膜剥除和单纯PPV的手术后相对手术前基线视力的变化值、中央视网膜厚度变化值及手术中和手术后并发症发生情况。对于视力变化值,分析结果显示:手术后1个月的视力较基线无显著差异(1项研究[56],P=0.72);手术后3、6个月,PPV联合内界膜剥除组的视力改善均优于单纯PPV组(手术后3个月:2项研究[56, 61],-0.09 logMAR单位,95%CI -0.12~-0.07,P<0.000 01;手术后6个月:5项研究[56-59, 61],-0.09 logMAR单位,95%CI -0.12~-0.05,P<0.000 01);而手术后1年(5项研究[56, 58-61],P=0.25)及1年以上(最长随访时间点为5年)视力较基线的变化值,两组间差异无统计学意义(3项研究[56, 58-59],P=0.45)(表6,图7)。对于中央视网膜厚度变化值,共3项研究[57, 60-61](164只眼)报告了此指标。分析结果(证据等级Ⅲ)显示:手术后3、6个月,两组间差异无统计学意义(P=0.78、1.00);手术后12个月,PPV联合内界膜剥除组的中央视网膜厚度较基线的下降值均显著大于单纯PPV组(中位数-82.21 μm,95%CI -94.12~-70.30,P<0.000 01),说明PPV联合内界膜剥除能够较好地减轻黄斑水肿(表6,图8)。对于手术中并发症情况,基于2项研究[57, 59](155只眼)的荟萃分析结果显示,PPV联合或不联合内界膜剥除手术在手术中医源性视网膜裂孔的发生率方面无显著差异(P=0.95)(表6,图9)。对于手术后并发症情况,共3项研究[56, 59, 61](254只眼)报告了手术后高眼压、黄斑中心硬性渗出及新生血管性青光眼的发生率情况。荟萃分析结果(证据等级Ⅲ)显示:手术后高眼压(P=0.87)、黄斑中心硬性渗出物(P=1.00)及新生血管性青光眼(P=0.75)的发生率在两组间均无统计学差异(表6,图10)。
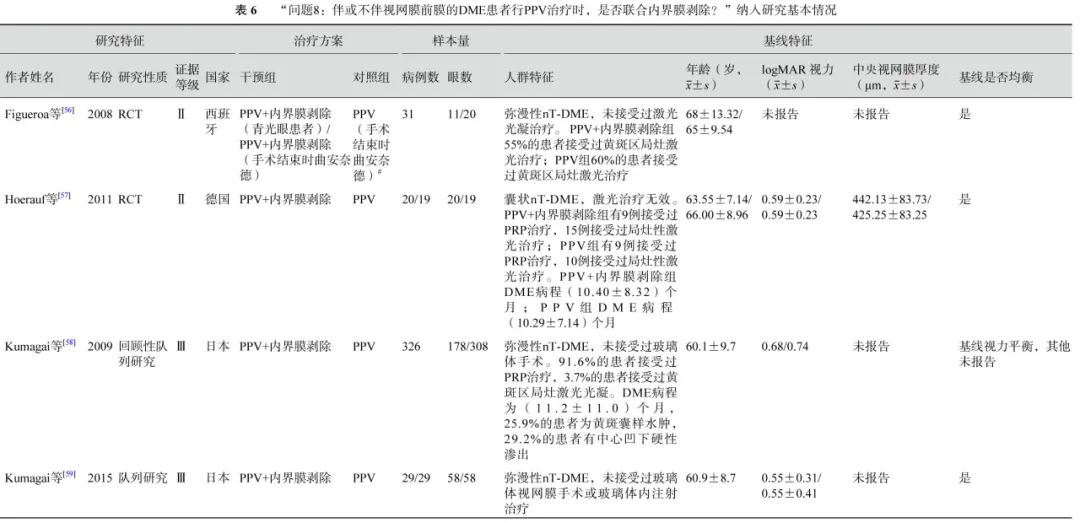
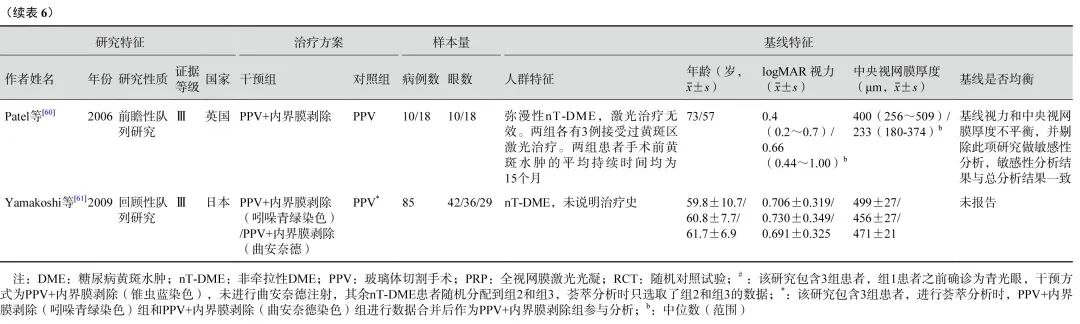
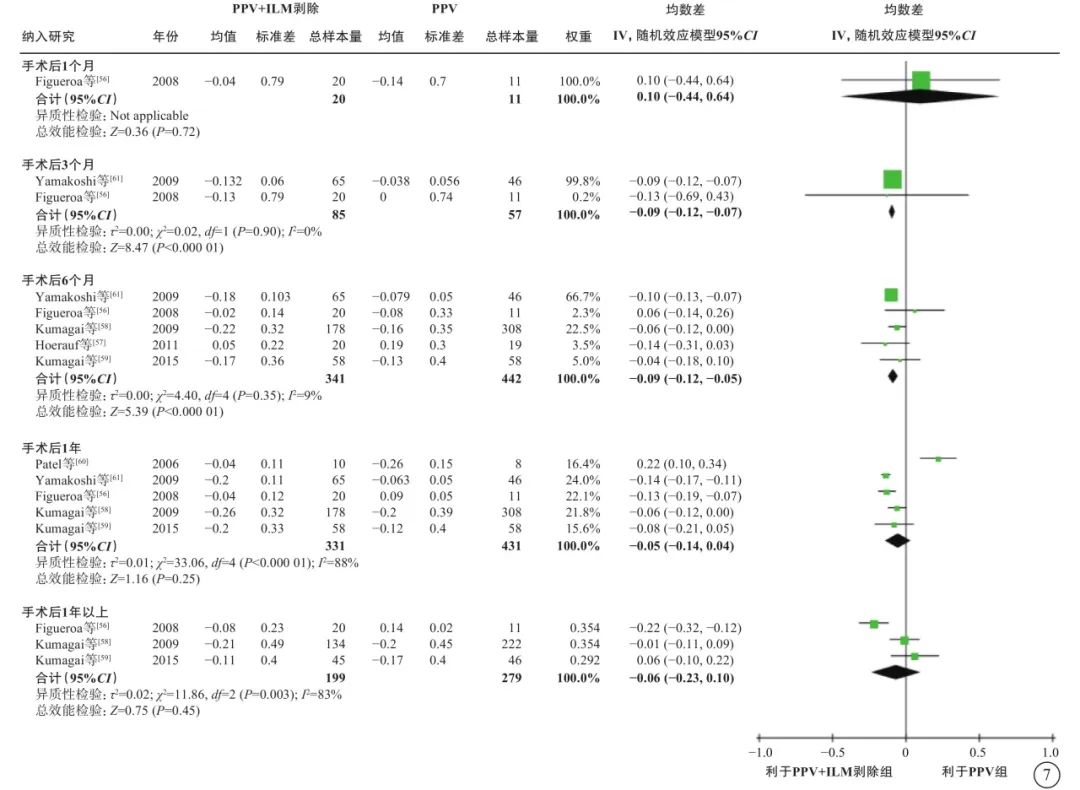
图7 nT-DME患者PPV联合或不联合ILM剥除手术后视力变化值(logMAR单位)比较 nT-DME:非牵拉性糖尿病黄斑水肿;PPV:玻璃体切割手术;ILM:内界膜;logMAR:最小分辨角对数;CI:可信区间
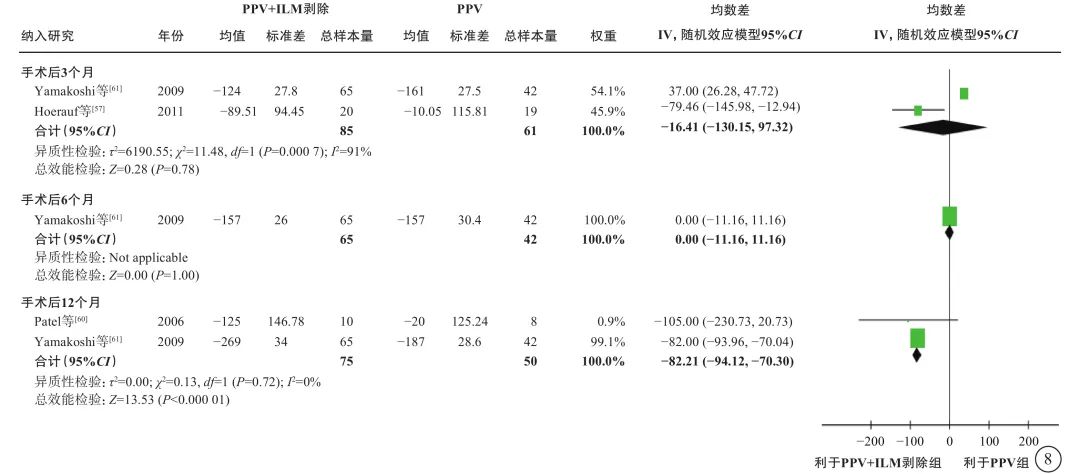
图8 nT-DME患者PPV联合或不联合ILM剥除手术后中央视网膜厚度变化值(μm)比较 nT-DME:非牵拉性糖尿病黄斑水肿;PPV:玻璃体切割手术;ILM:内界膜;CI:可信区间;Not applicable:不适用
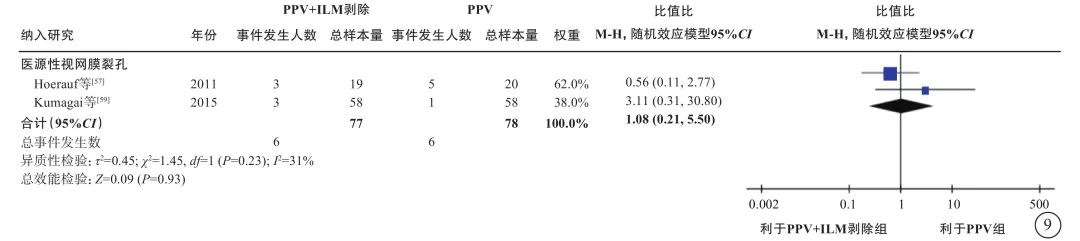
图9 nT-DME患者PPV联合或不联合ILM剥除手术中并发症发生率比较 nT-DME:非牵拉性糖尿病黄斑水肿;PPV:玻璃体切割手术;ILM:内界膜;CI:可信区间
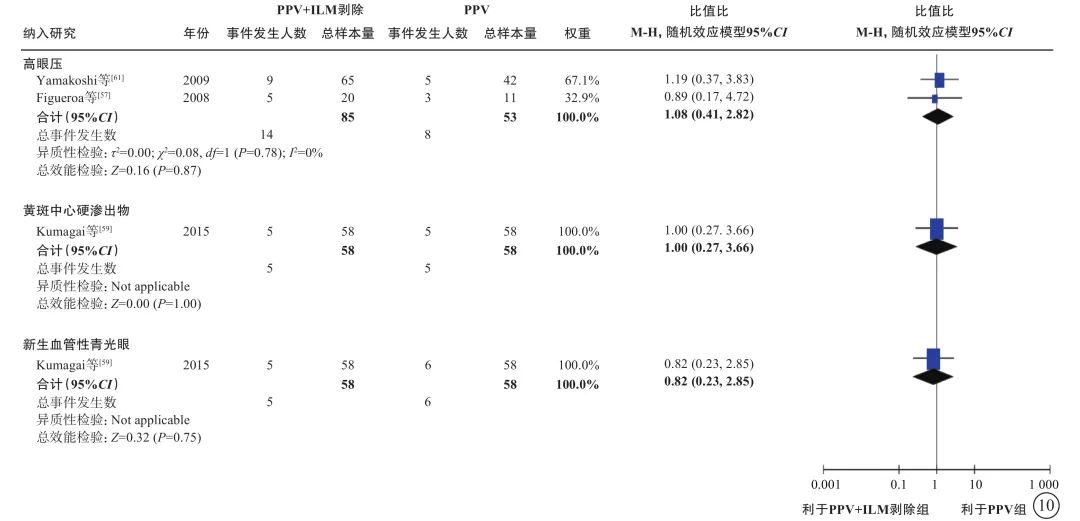
图10 nT-DME患者PPV联合或不联合ILM剥除手术后并发症发生率比较 nT-DME:非牵拉性糖尿病黄斑水肿;PPV:玻璃体切割手术;ILM:内界膜;CI:可信区间;Not applicable:不适用
两项研究[62-63]探讨了对伴有ERM的DME患者行PPV治疗时,在存在ERM的情况下是否推荐同时剥除内界膜。发表于2005年的一项RCT[62](证据等级Ⅱ)纳入了视力在20/40(Snellen视力表)或以下的弥漫性DME患者29例30只眼,并将其随机分为内界膜剥除组(15只眼)和内界膜保留组(15只眼),随访观察(9.5±1.7)个月。内界膜剥除组中3只眼(20%)存在ERM,内界膜保留组中6只眼(40%)存在ERM,PPV中均将ERM予以剥除,同时尽量清除残余玻璃体皮质和后玻璃体等视网膜中央凹前物质。手术后末次随访时,两组患者BCVA均较手术前显著提高,且两组间BCVA较基线变化值以及较基线视力改善(内界膜剥除组、保留组分别为47%、60%)和视力维持(内界膜剥除组、保留组分别为53%、60%)的患者比例均无统计学差异(P=0.493 8)。两组患者手术后1周及1、2、3、4、5、6个月平均视网膜厚度均较手术前明显变薄,但所有时间点两组的视网膜厚度差异无统计学意义。两组患者均未发生严重的手术中并发症。而另一项回顾性队列研究[63](证据等级Ⅲ)纳入累及黄斑中心凹的DME患者45例53只眼,对存在ERM的患眼予以ERM剥除(23只眼),视情况对部分患眼行内界膜剥除(35只眼)。单因素方差分析结果表明,内界膜剥除(P=0.007 0)和ERM剥除(P=0.042 5)与手术后12个月视力改善有关;而多因素方差分析结果则表明,内界膜剥除(P=0.075 2)、ERM剥除(P=0.868 4)及眼内糖皮质激素注射与手术后12个月视力改善无关,同样印证了上述结果,即伴有ERM的DME患者行PPV治疗时,剥除ERM合并内界膜剥除不能进一步改善手术后视力。
问题9:PDR合并白内障患者行PPV时,是否推荐联合行白内障摘除及人工晶状体(IOL)植入手术?
推荐意见:当白内障形成影响PPV时,要考虑联合白内障手术。但鉴于目前的证据,不形成推荐意见。
5项观察性研究[64-68](599只眼)报道了PDR合并白内障患者行PPV时联合或不联合白内障手术的临床效果(表7)。其结果表明,PDR患者行PPV时联合或不联合白内障手术的手术后视力、VH和TRD发生率没有显著性差异,PDR患者PPV联合白内障手术会增加手术后短期的炎症反应(纤维蛋白形成、虹膜粘连、角膜水肿)。
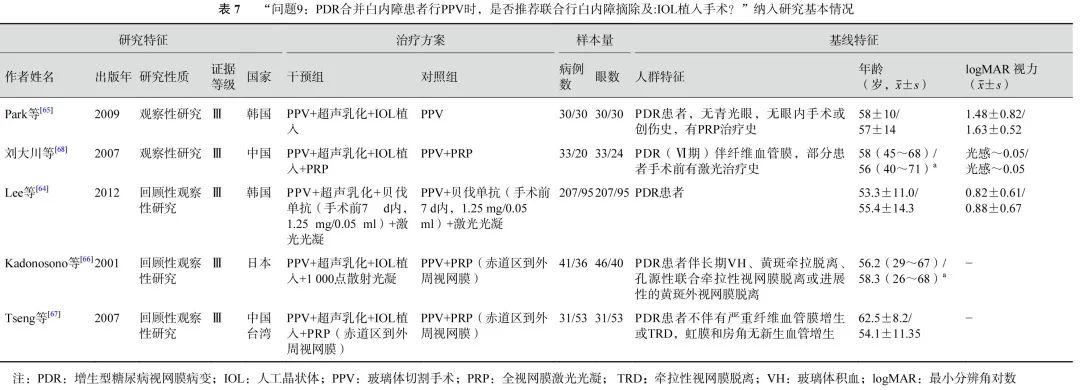
基于2项研究[64, 66](388只眼)的荟萃分析(证据等级Ⅲ)结果显示:联合组与单纯PPV组之间手术中VH(OR=0.71,95%CI 0.25~2.01,P=0.52)、医源性视网膜裂孔(OR=0.57,95%CI 0.25~1.27,P=0.17)的发生率无显著差异(表6,图11)。联合组与单纯PPV组之间手术后VH(3项研究[64, 66-67] ,OR=0.43,95%CI 0.14~1.29,P=0.13)、前房渗出(1项研究[68],OR=5.11,95%CI 0.57~45.62,P=0.14)、高眼压(4项研究[64-65, 67-68],OR=1.84,95%CI 0.90~3.75,P=0.09)和视网膜脱离(2项研究[64, 66],OR=0.52,95%CI 0.08,3.46,P=0.50)的发生率均无显著差异(表6,图12)。3项研究(证据等级Ⅲ)报告了手术后其他前房并发症的发生情况。结果显示,联合组手术后纤维蛋白形成[65-66](30% vs. 7%,P=0.042;17% vs. 2%,P=0.019)、手术后2周虹膜粘连[65](30% vs. 7%,P=0.042)、手术后角膜水肿[66](36.4% vs. 8.3%,P<0.05)的发生率显著高于单纯PPV组。而两组间瞳孔后粘连[68](3.0% vs. 4.2%,P=1.000)、手术后前房出血[67](0.0% vs. 1.9%,P=0.631)、新生血管性青光眼[67](0.0% vs. 1.9%,P=0.631)、角膜混浊[66](2.2% vs. 4.3%,P>0.05)的发生率差异均无统计学意义。
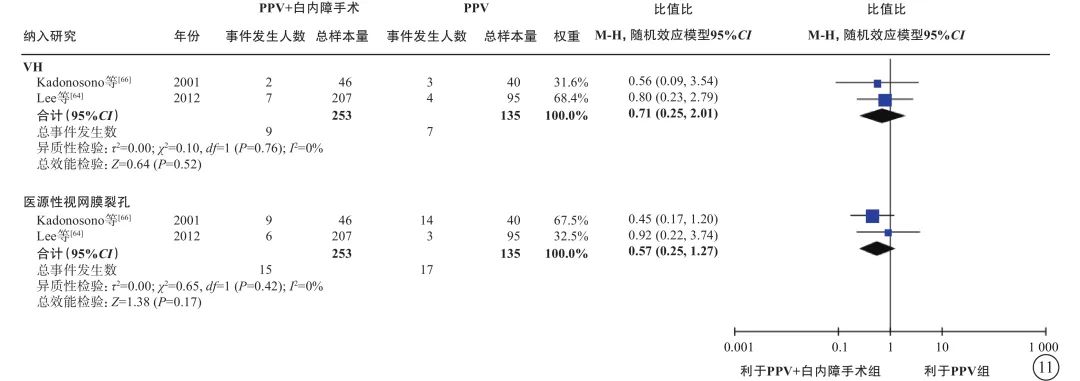
图11 PDR合并白内障患者PPV联合或不联合白内障手术的手术中指标比较 PDR:增生型糖尿病视网膜病变;PPV:玻璃体切割手术;VH:玻璃体积血;CI:可信区间
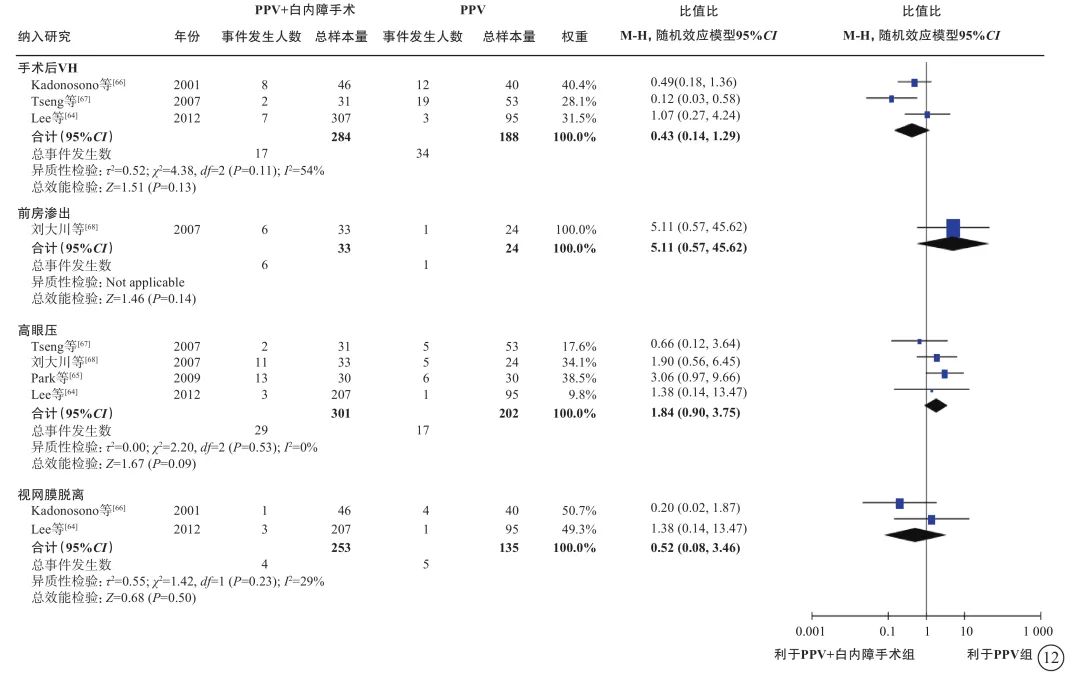
图12 PDR合并白内障患者PPV联合或不联合白内障手术的手术后并发症指标比较 PDR:增生型糖尿病视网膜病变;PPV:玻璃体切割手术;VH:玻璃体积血;CI:可信区间
共5项研究[64-67, 69](448只眼)报告了PDR合并白内障患者行PPV时联合或不联合白内障手术的视力预后情况(证据等级Ⅲ)。Lee等[64]和Park等[65]研究发现,手术后1、2、3、6个月,两组间视力差异均无统计学意义(P>0.05)。Kadonosono等[66]经过18.3(7~24)个月的随访观察亦发现,两组患者视力差异无统计学意义(P>0.05)。王萍等[69]通过一项回顾性队列研究纳入合并不同程度白内障的PDR患者72例82只眼,将其分为3组:A组25例28只眼,行PPV同期联合白内障超声乳化及IOL植入手术;B组20例24只眼,行玻璃体腔注射anti-VEGF药物辅助PPV,同期联合白内障超声乳化及IOL植入手术;C组27例30 只眼,Ⅰ期行PPV,Ⅱ期行硅油取出联合白内障超声乳化及IOL植入手术。患者手术后随访(9.0±2.5)(6~12)个月,A组、B组、C组患者手术后logMAR BCVA 分别为1.007±0.455、1.000±0.482、1.033±0.531,三组患者视力较手术前均有明显提高(P<0.05),但三组间差异无统计学意义(P=0.195)。Tseng等[67]纳入84例84只眼观察发现,联合组[随访(15.6±7.0)个月]患者视力提高1行或更多的比例显著高于单纯PPV组[随访(16.1±0.5)个月](67.7% vs. 32.1%,P=0.003)。
3 展望
针对DR的手术治疗,尤其是涉及玻璃体视网膜手术的操作,其复杂性和挑战性主要取决于眼科医生的专业知识、技术水平及临床经验。鉴于此领域的多样性和复杂性,很难就具体的手术细节达成一致意见。本专家共识旨在为中国眼科专科医生以及从事眼底病专业的医生提供临床指导,但不应被视为具有法律效力的医疗依据。
基于对现有证据的综合评估,我们建议在中国人群中进行更系统性的研究,以验证PPV是否能够有效控制DR患者增生早期的病情进展。这些研究将为未来的 DR治疗决策、指南制定以及实际临床实践提供坚实的基础和可靠的科学依据。
形成指南意见的专家组成员
临床主席
黎晓新 厦门大学附属厦门眼科中心/北京大学人民医院(执笔人)
许 迅 上海交通大学医学院附属第一人民医院
方法学联席主席
夏 君 宁波诺丁汉GRADE中心
核心专家(按照姓氏拼音排序)
常 青 复旦大学附属眼耳鼻喉科医院
丁小燕 中山大学中山眼科中心
李筱荣 天津医科大学眼科医院
梁建宏 北京大学人民医院
刘 堃 上海交通大学医学院附属第一人民医院
陆 方 四川大学华西医院
罗 静 中南大学湘雅二医院
吕 林 中山大学中山眼科中心
马 进 中山大学中山眼科中心
孙晓东 上海交通大学医学院附属第一人民医院
唐仕波 中南大学爱尔眼科学院
陶 勇 首都医科大学附属北京朝阳医院
王雨生 空军军医大学西京医院
魏文斌 北京同仁医院
邢怡桥 武汉大学人民医院
徐格致 复旦大学附属眼耳鼻喉科医院
于伟泓 北京协和医院
张 风 北京同仁医院
张美霞 四川大学华西医院
张 明 四川大学华西医院
张少冲 深圳市眼科医院
赵明威 北京大学人民医院
赵培泉 上海交通大学医学院附属新华医院
周 鹏 上海百汇医院
讨论专家(按照姓氏拼音排序)
常 青 复旦大学附属眼耳鼻喉科医院
陈晓隆 中国医科大学附属盛京医院
陈 宜 北京中日友好医院
陈长征 武汉大学人民医院
戴 虹 北京医院
丁小燕 中山大学中山眼科中心
惠延年 空军军医大学西京医院
黎晓新 厦门大学附属厦门眼科中心/北京大学人民医院
李海平 北京大学第三医院
李秋明 郑州大学第一附属医院
李甦雁 徐州市第一人民医院
李筱荣 天津医科大学眼科医院
梁建宏 北京大学人民医院
刘庆淮 南京医科大学第一附属医院
刘晓玲 温州医科大学附属眼视光医院
刘 勇 第三军医大学西南医院
柳 林 上海交通大学医学院附属仁济医院
陆 方 四川大学华西医院
罗 静 中南大学湘雅二医院
吕 林 中山大学中山眼科中心
马 进 中山大学中山眼科中心
马 翔 大连医科大学附属第一医院
苗 恒 北京大学人民医院
彭绍民 哈尔滨医科大学附属第二医院
曲进锋 北京大学人民医院
沈 玺 上海交通大学医学院附属瑞金医院
宋艳萍 中国人民解放军中部战区总医院
宋宗明 河南省立眼科医院
苏冠方 吉林大学第二医院
孙大卫 哈尔滨医科大学第二附属医院
孙晓东 上海交通大学医学院附属第一人民医院
孙旭芳 华中科技大学同济医学院附属同济医院
唐罗生 中南大学湘雅二医院
唐仕波 中南大学爱尔眼科学院
陶 勇 首都医科大学附属北京朝阳医院
万光明 郑州大学第一附属医院
王常观 北京大学第三医院
王 方 同济大学附属第十人民医院
王 鲜 贵州医科大学附属医院
王艳玲 首都医科大学附属北京友谊医院
王雨生 空军军医大学西京医院
王志军 北京中日友好医院
魏文斌 北京同仁医院
邢怡桥 武汉大学人民医院
徐格致 复旦大学附属眼耳鼻喉科医院
徐国兴 福建医科大学第一临床医学院
许 迅 上海交通大学医学院附属第一人民医院
杨 波 吉林大学第二医院
柳 林 上海交通大学医学院附属仁济医院
姚 勇 无锡市人民医院
于伟泓 北京协和医院
于旭辉 哈尔滨医科大学附属第一医院
俞素勤 上海交通大学医学院附属第一人民医院
喻晓兵 北京医院
张 风 北京同仁医院
张美霞 四川大学华西医院
张 明 四川大学华西医院
张少冲 深圳市眼科医院
张文芳 兰州大学第二医院
赵明威 北京大学人民医院
赵培泉 上海交通大学医学院附属新华医院
赵铁英 深圳市眼科医院
周 鹏 上海百汇医院
朱 丹 内蒙古医学院附属医院
庄文娟 宁夏医学院附属医院
参考文献略。
-END-
声明:本文转载于<中华眼底病杂志>,仅用于学习交流,版权归原作者所有。如有侵权违规,请立即联系我们。
















