
上海市医学会胸外科专科分会,上海市医师协会胸外科医师分会,普胸外科临床能力促进与提升专科联盟
同济大学附属上海市肺科医院 胸外科 (上海 200433 )
通信作者:陈昶,Email: chenthoracic@163.com
关键词:早期肺癌;多原发肺癌;专家共识
引用本文:上海市医学会胸外科专科分会,上海市医师协会胸外科医师分会,普胸外科临床能力促进与提升专科联盟. 多原发早期肺癌诊疗专家共识. 中国胸心血管外科临床杂志, 2022, 29(12). doi: 10.7507/1007-4848.202210015

1 方法与证据
在撰写本共识过程中,团队检索了PubMed、 Web of Science、中国知网、NCCN 指南、 Fleischner学会指南以及中国临床肿瘤学会指南等,分析了近20年来相关文献资料,结合国际现行临床指南,旨在为多原发早期肺癌诊疗提供参考。本共识经3次专家讨论会修订并最终定稿。
本共识的共识等级分为:1A级、1B 级、 2A 级、2B级、3级。
1A级:基于高水平证据(严谨的Meta 分析或大型随机对照临床试验结果),专家组一致同意;
1B级:基于高水平证据(严谨的Meta 分析或大型随机对照临床试验结果),专家组基本同意,但有小争议。
2A级:基于低水平证据(质量一般的系统评价/Meta分析、小型随机对照研究、大型回顾性研究、病例对照研究),专家组一致同意。
2B级:基于低水平证据(质量一般的系统评价/Meta分析、小型随机对照研究、大型回顾性研究、病例对照研究),专家组基本同意,但有小争议。
3 级:专家组存在较大争议。

2 诊断与分期
2.1 多部位肺癌分类
根据影像学表现和病理特征,国际肺癌研究协会公布的第8版肺癌TNM分期将多部位肺癌分为4类:第二原发肺癌(second primary lung cancer)、肺内转移(separate tumor nodules/intrapulmonary metastasis)、多发磨玻璃结节(multifocal ground glass/lepidic nodules)、肺炎型肺癌(pneumonic-type lung cancer)[12]。其中,第二原发肺癌与多发磨玻璃结节的各个病灶间无同源性,即多原发肺癌;而肺内转移的多个病灶被认为具有同一来源。
2.2 同时性多原发肺癌和与肺内转移的鉴别标准
2.2.1 Martini-Melamed 标准
1975 年,Martini 等[13]提出第一项区分多原发肺癌和肺内转移的Martini-Melamed(M-M)标准,此标准以肿瘤部位、病理形态、是否出现远处转移为依据,见表1。

但M-M标准存在其局限性,主要包括:①大部分腺癌患者都表现出混合的组织学特征,对于这部分患者M-M标准难以鉴别;②淋巴结状态对于多原发肺癌和肺内转移的鉴别能力有限[14];③M-M标准区分多原发肺癌和肺内转移患者,预后没有显著差异[15-16]。
2.2.2 ACCP 标准
在M-M 标准的基础上, ACCP将分子遗传学指标加入区分多原发肺癌和肺内转移的诊断标准[17];见表2。

2.2.3 综合组织病理评估
综合组织病理评估由Girard等[18]提出,通过对比不同病灶间组织学类型、主要组织学亚型、次要组织学亚型、细胞学和基质特征(是否有坏死、炎症、淋巴增生和角化等)等区分多原发和肺内转移,并且综合组织学评估的结果与分子评估结果也高度吻合。因此,该方法也被国际肺癌研究协会推荐用于区分多原发肺癌与肺内转移[19],见图1。但综合组织病理评估仍存在其局限性,主要由于其结果受标本质量和观察者之间的差异的影响,且该评估方法受观察者主观影响较大[18, 20]。
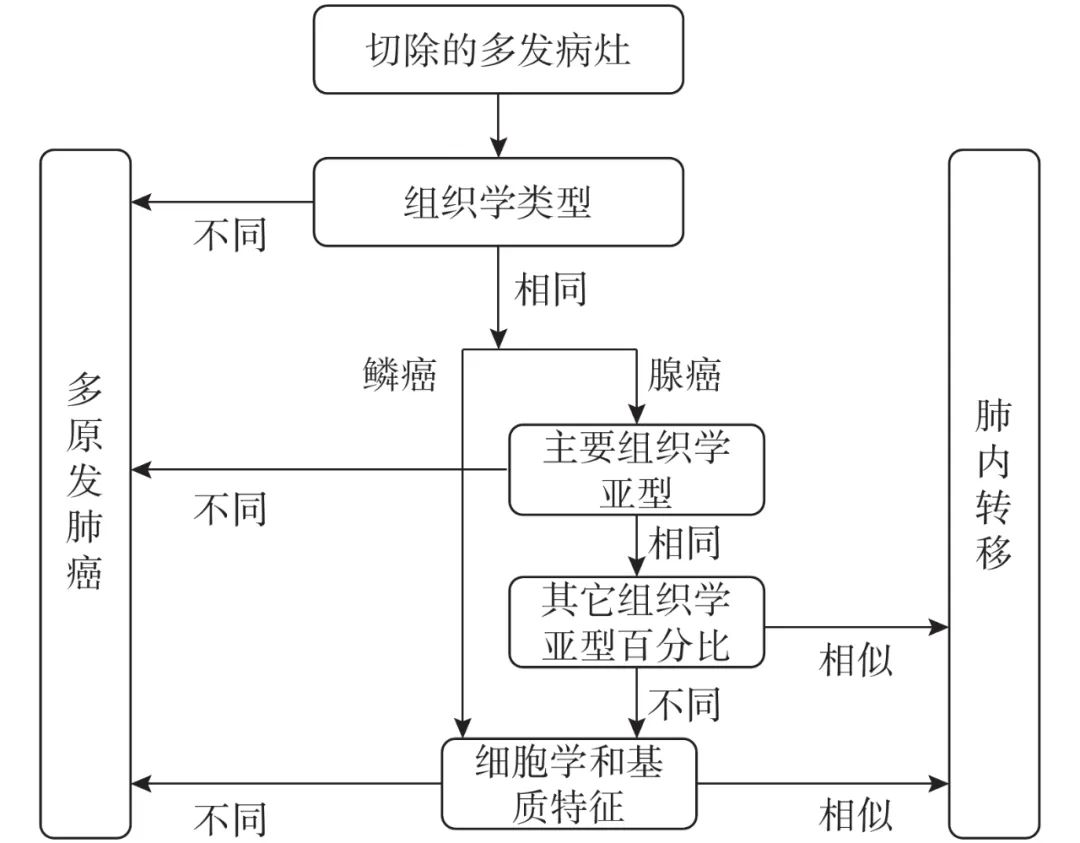
图 1 综合组织病理评估流程图[19]
2.2.4 PET-CT 区分多原发与肺内转移
CT表现为同期多发肺部结节的病灶往往难以区分多原发肺癌或肺内转移,这时往往需要行PET-CT和/或头颅磁共振以确认患者是否出现淋巴结转移和远处转移[21],以区分多原发肺癌和肺内转移。另有研究[22-23]报道,标准化摄取值(standardized uptake value,SUV)的差异值(ΔSUV)也可用于区分多原发肺癌与肺内转移,多原发肺癌间的ΔSUV 要显著高于转移患者。
2.2.5 分子遗传学评估
分子遗传学用于区分多原发肺癌和肺内转移可追溯至1995 年,Antakli等[24]在M-M标准的基础上添加了DNA倍体检测用于区分多原发肺癌和肺内转移,但由于技术限制并未得到广泛应用。
(1)驱动基因突变。不同肿瘤间发生相同基因突变的可能性主要由基因突变频率决定,即如果多个肿瘤共享同一突变基因,当这个基因的突变频率越低时,多个肿瘤属于同一克隆起源的可能性越大,诊断价值愈大。当扩大基因检测数量并增加突变频率低的基因时,可以有效提升判别准确率。有研究[14]认为,病灶间有至少两个相同的驱动突变或具有相同的罕见突变,可诊断为肺内转移;当病灶间无相同的驱动突变时,可诊断为多原发肺癌。
(2)染色体重排。研究[25-26]发现多原发肺癌间几乎没有相同的染色体重排现象,但在肺内转移中相同的染色体重排较为常见,但这一方法的判定结果与综合组织学评估结果是否一致及判定结果的准确性仍有赖于更进一步的研究。
(3)其它分子评估方法。据报道,某些肿瘤相关蛋白(c-erbB2、p16 等)表达差异也可用于区分多原发肺癌与肺内转移[27-28]。此外,微卫星不稳定灶等分子异常现象也被证明有区分多原发肺癌和肺内转移的能力[29]。

3 多部位肺癌分期
根据第8 版TNM分期[12],不同类型的多部位肺癌,甚至不同影像学表现的多原发肺癌分期都存在差异。对于肺内转移,病灶同叶分期为T3,病灶同肺不同叶分期为T4,病灶位于对侧肺分期为M1a(此时T按照最大病灶直径评估),N分期和M分期根据患者情况进行总体评估;对于第二原发肺癌,每个病灶均单独评估T、N、M 分期;对于多发磨玻璃结节,T分期按照结节的最高T分期标注,并用括号标注磨玻璃结节的个数(用“m”或 “#”表示),N分期和M分期按照患者情况进行总体评估;对于肺炎型肺癌,病灶同叶分期为T3,病灶同肺不同叶分期为T4,病灶位于对侧肺分期为M1a(此时T按照最大病灶直径评估),N分期和M分期根据患者情况进行总体评估。
共识要点:(1)综合组织病理评估病灶间组织学类型、主要组织学亚型、次要组织学亚型、细胞学和基质特征可区分多原发肺癌与肺内转移(2A)。
(2)病灶间无相同驱动基因突变时,可诊断为多原发肺癌;病灶间共享至少两个相同的驱动突变或具有相同的罕见突变,可诊断为肺内转移(2B)。
4 多原发肺癌的手术治疗
对同期多发肺部结节的治疗,目前相关高质量的研究较少。大多数多原发肺癌表现为多发磨玻璃样病灶,手术是处理多原发肺癌主要和最有效的手段[4, 16, 30]。术前PET-CT 和/或头颅磁共振成像、腹部CT及骨扫描可用于排除远处转移,胸部CT、支气管镜或纵隔镜评估纵隔淋巴结情况,手术方式及手术时机的确定主要根据病灶位置、影像特征和患者心肺功能确定[31],术前进行多学科(胸外科、呼吸科、病理科、影像科、麻醉科等)讨论共同制定个体化治疗方案。
对于同时性多原发肺癌,若多个结节位于同一肺叶,可采取多部位楔形切除或肺段切除或肺叶切除。若多个结节位于同肺不同肺叶或双侧肺,应根据患者情况个性化规划手术方案,一般主病灶以肺叶或肺段切除为主(视主病灶直径及影像特征确定),次要病灶采取楔形切除或肺段切除[32]。对于多原发早期肺癌,满足充分切除的原则下尤其应该注重肺功能的保护,避免采取全肺切除术。
总的来看,同期手术是多原发早期肺癌的治疗首选。是否进行同期手术应综合考虑病灶部位、患者手术耐受性以及术者经验。双侧同期手术通过一次麻醉将全部病灶切除,手术时先行处理手术范围较小的一侧,以保证其它病灶的安全切除,可减少二次手术的创伤应激。但由于术后双侧胸廓呼吸受限,会增加术后发生呼吸衰竭的风险。当同期手术有风险时,考虑先行切除主要病灶(中央型、进展快、病灶大、实性成分多、恶性征象明显),在患者情况允许的情况下再切除次要病灶(周围型、进展慢、病灶小)[30, 33],分期手术一般时间间隔为6~8 周(另有专家推荐3~4 个月)[16, 32]。规划手术时应注意总切除范围不应大于10 个肺段,浸润性病灶位于双侧肺需行双侧纵隔淋巴结清扫或采样时,应注意保护迷走神经和膈神经,以免出现胃瘫或双侧膈肌瘫痪[32]。
共识要点:(3)对于多原发早期肺癌,术前应评估病灶位置、大小、数目,根据CT表现分清主要病灶和次要病灶,分期手术时优先手术处理主要病灶,兼顾次要病灶;同期手术时术中先处理次要病灶(2A)。
(4)病灶在同一肺叶内可选择肺叶切除、多处楔形或肺段切除;同侧肺不同肺叶或双侧肺叶病灶,在患者可以耐受手术的前提下,以最大程度保护肺功能为主要原则,可采取分期手术的策略以降低手术风险,不推荐双侧肺叶切除或全肺切除(2A)。
5 多原发肺癌的消融治疗
5.1 消融原理及相关研究
NCCN推荐肺癌消融治疗的主要方式包括射频消融、微波消融和冷冻消融,射频消融和微波消融使用热效应破坏肿瘤细胞,冷冻消融使用低温破坏肿瘤细胞。一篇包含53 项研究的Meta分析显示,对于原发性肺癌的治疗,使用射频消融或微波消融对中位生存时间差异并无统计学意义[34]。微波消融使用电磁场使周围组织产生60~150°C高温,导致组织蛋白变性、凝固、坏死[35]。与射频消融相比,微波消融热传导损失更少,热沉效应更低(微波消融可使其周围小血管血栓化),局部温度上升更快,平均消融直径增大约25%,平均消融横截面积增大约50%。而射频消融受到肺组织高电阻率的阻碍,限制了能量沉积,持续融蚀又会引起组织变化,如碳化和干燥,增加组织电阻率,从而进一步阻碍融蚀区的扩展[35]。冷冻消融通过探头产生-140°C的低温,持续时间25~30 min,通过蛋白质变性、膜破裂和微血管血栓形成诱导细胞死亡。与射频消融和微波消融相比,冷冻消融术后患者疼痛较轻,局部组织可以保存更多的胶原结构,故适合膈肌、气道、胸膜附近的病灶治疗,但耗时显著更长,且更易发生出血[36-37]。
现阶段关于热消融治疗早期肺癌的研究大多为回顾性研究,证据等级较低。研究[38]报道,对于高风险不适合手术的Ⅰ期肺癌患者,消融治疗可以获得与肺叶切除同近的预后。Zemlyak等[39]比较了接受亚肺叶切除和射频消融的Ⅰ期肺癌患者预后,结果显示无显著差别。肿瘤大小是影响消融后病灶复发的重要因素,≤3 cm的肿瘤消融后局部复发率较低,>3 cm的病灶可能因消融不完全以致局部复发率较高[40-41]。不同的组织学类型也会影响到消融后的长期预后。研究[42]表明具有微乳头和/或实性成分的Ⅰ期肺腺癌接受消融治疗后,复发率高于其它组织类型。
5.2 电磁导航支气管镜下热消融
经电磁导航支气管镜(Electromagnetic navigation bronchoscopy,ENB)热消融是近年来出现的新型消融方式,已有多项研究[43-46]报道其在多原发肺癌治疗中的优势。理论上ENB 可以到达有支气管通过或与支气管邻近的所有病灶,更适用于多原发病灶的消融治疗,尤其是位于双侧肺叶病灶及结节位置较深的患者,可达到一次同时治疗多个结节的目的。与经皮穿刺消融相比,ENB可以在一次手术中同时完成诊断与治疗,气胸发生率更低,术后疼痛更少[43- 44]。
5.3 操作要点
术前根据胸部CT选择治疗路径,针径应避开血管、肺气肿、肺大疱区域。术中可以同时应用快速现场评估(rapid on-site evaluation,ROSE)对标本进行即时分析,提高诊断时效性和准确性[47]。根据不同消融设备选择最佳的功率和时间,消融完毕后确认消融边缘超过原病灶10 mm区域,以确定消融完全[35, 48]。若病灶较大或形状不规则,可能需要多个角度消融,以达到充分消融的目的[49-51]。消融术后注意监测患者生命体征,术后复查胸部X线片,排除气胸、胸腔积液等并发症,如有特殊情况复查CT。
共识要点:(5)位于不同肺叶的多原发肺癌(排除转移性病灶)、病灶直径≤3 cm、心肺功能差或合并其它疾病无法耐受手术或拒绝行手术治疗的患者,可考虑接受消融治疗(2A)。
(6)消融路径的选择可根据医院条件、操作者经验优选,病灶位置较深时(内2/3 肺野)优先行电磁导航下消融治疗(2B)。
(7)消融边缘应覆盖并超过病灶10 mm范围,以达到完全消融病灶的目的(2B)。
6 手术联合消融治疗多原发肺癌
近年来随着手术理念和设备的不断创新发展,出现多原发早期肺癌的“一站式”诊疗模式,可通过一次手术治疗所有病灶,为患者保留更多肺功能。
2021年,Bao等[43]报道胸腔镜(video-assisted thoracoscopic surgery,VATS)手术联合ENB 下消融治疗多原发肺癌的新模式,10例患者接受了VATS 联合ENB 引导消融杂交手术(切除结节大小:5~32 mm;消融结节大小:5~17 mm)。术后4例患者出现并发症(2 例咯血、1例肺部感染、 1例漏气),但未发生手术相关死亡事件。Qu等[45]也报道11 例多发病灶患者接受VATS 联合ENB 引导消融杂交手术治疗,术后仅1 例患者发生气胸和皮下气肿。在以上两项研究中,主病灶接受手术切除治疗,次要病灶接受消融治疗。手术联合消融诊疗新模式是对多原发肺癌治疗模式的积极探索,未来仍需要大样本、前瞻性临床试验证实其治疗多原发肺癌的安全性和有效性。
共识要点:(8)VATS 联合ENB 下消融可用于治疗部分多原发早期肺癌患者,主病灶采取手术切除,次要病灶采取消融治疗(2B)。
7 随访
7.1 接受手术治疗的患者随访
对于行手术切除的多发肺癌患者,术后如无明显残余病灶,术后2 年内每6个月随访1 次胸部CT,之后每年随访1 次CT[52]。
若患者术后仍有残余病灶,则根据残余病灶情况进行随访。(1)残余病灶为纯磨玻璃结节且直径<8 mm时每年复查1 次CT;纯磨玻璃结节直径 ≥8 mm时建议3~6 个月复查CT检查结节是否稳定增长,若无增长每年复查CT,若出现增长则应考虑再次手术或其它治疗方式。(2)残余病灶为部分实性结节或纯实性结节,当实性成分直径<6 mm时每6~12个月复查1 次CT;实性成分直径≥6 mm时建议3~6个月复查CT观察结节是否稳定增长,若无增长每年复查CT,若出现增长则应考虑再次手术或其它治疗方式[53]。
7.2 接受消融治疗的患者随访
随访:术后1 个月、3个月复查胸部CT,观察是否完全消融。此后,6个月复查1 次CT,观察消融结节是否复发、是否出现新发结节。两年后改为每年复查1次CT[35, 54]。
消融后病灶影像学表现:消融后病灶区域因细胞坏死出现出血、水肿、渗出等征象,随之组织坏死,溶解吸收,而后坏死组织被肉芽组织取代,逐渐形成纤维化,在CT上表现为密度更高、直径更大的融蚀区。此后,融蚀区直径保持稳定或逐渐减小。(1)早期改变:病灶内可出现实性或低密度泡影样改变,围绕着融蚀区周边形成的消融后磨玻璃影,一般认为磨玻璃影超出肺结节周边边缘10 mm可认为肺结节完全消融,在磨玻璃影外出现一层密度稍高于磨玻璃影的反应带;(2)中期改变:融蚀区可持续增大,消融后磨玻璃影消失,其周边可能出现环绕的边缘清晰的高密度带;(3)后期改变:与基线(一般以消融后4~6周时的CT表现为基线)相比融蚀区在治疗3个月后病灶保持稳定,随后的CT随访过程中病灶区域有几种不同的演变模式:如消失、缩小纤维化、空洞、结节、肺不张、增大(可能增生纤维化)等[35, 54-55]。
复发评估:由于消融后融蚀区的出现,实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)并不适用于消融结节的疗效评估。目前,对于消融结节的复发评估尚没有统一的标准,一般认为融蚀区出现新发且稳定增长的结节成分,可能出现复发,有待进一步病理学评估诊断。
此外,如有部分磨玻璃结节未接受治疗,在随访中也该密切关注其生长情况,临床上一般认为进展标准为:(1)结节直径或实性部分直径增加超过2 mm;(2)结节中出现新的实性成分[56]。
共识要点:(9)消融病灶应在消融后1个月、3个月及其后每6 个月复查胸部CT,监测消融后病灶动态变化,注意甄别复发与消融后炎性反应(2A)。

8 结语
手术是多原发早期肺癌的主要治疗方式,但在治疗过程中还需注意保护患者肺功能。此外,手术切除主要病灶联合消融治疗次要病灶的多发肺癌新治疗模式也在探索中。总的来说,本共识在充分查阅现有文献的基础上,专门探讨多原发肺癌的诊断、治疗进展,旨在为临床医生诊疗多原发早期肺癌提供参考,进一步提高我国肺癌规范化诊疗水平。
利益冲突:无。
特邀顾问:高文(华东医院)、费苛(华东疗养院)、姜格宁(同济大学附属上海市肺科医院)、徐志飞(海军军医大学第二附属医院)、赵珩(上海市胸科医院)
执笔:王放(同济大学附属上海市肺科医院)、岳鹏(兰州大学第一医院)、苏杭(同济大学附属上海市肺科医院)
讨论和审稿专家(按姓名拼音排序):白冲(海军军医大学第一附属医院)、包敏伟(同济大学附属上海市肺科医院)、鲍熠(同济大学附属上海市肺科医院)、曹传武(同济大学附属第十人民医院)、陈昶(同济大学附属上海市肺科医院)、陈成(遵义医科大学附属医院)、陈和忠(海军军医大学第一附属医院)、陈建乐(南通大学附属医院)、陈乾坤(同济大学附属上海市肺科医院)、陈巍(上海交通大学医学院附属瑞金医院)、池浩(上海中医药大学附属曙光医院)、池嘉昌(上海交通大学医学院附属仁济医院)、戴晨阳(同济大学附属上海市肺科医院)、董正伟(同济大学附属上海市肺科医院)、董志毅(同济大学附属上海市肺科医院)、段亮(同济大学附属上海市肺科医院)、范江(上海市第一人民医院)、范军强(浙江大学医学院附属第二医院)、方文涛(上海市胸科医院)、葛棣(复旦大学附属中山医院)、顾晔(同济大学附属上海市肺科医院)、韩彪(兰州大学第一医院)、何文新(同济大学附属上海市肺科医院)、侯立坤(同济大学附属上海市肺科医院)、胡坚(浙江大学医学院附属第一医院)、胡学飞(同济大学附属上海市肺科医院)、解明然(中国科学技术大学附属第一医院)、李鹤成(上海交通大学医学院附属瑞金医院)、李辉(首都医科大学附属北京朝阳医院)、李树海(山东大学齐鲁医院)、励新健(宁波市第一人民医院)、梁析(上海交通大学医学院附属第九人民医院)、马敏杰(兰州大学第一医院)、秦雄(同济大学附属上海市肺科医院)、任胜祥(同济大学附属上海市肺科医院)、任怡久(同济大学附属上海市肺科医院)、阮征(上海交通大学附属第一人民医院)、沈晓咏(华东医院)、宋楠(同济大学附属上海市肺科医院)、宋永祥(遵义医科大学附属医院)、苏春霞(同济大学附属上海市肺科医院)、谭黎杰(复旦大学附属中山医院)、唐华(海军军医大学第二附属医院)、田辉(山东大学齐鲁医院)、王海峰(同济大学附属上海市肺科医院)、王明松(上海交通大学医学院附属第九人民医院)、武春燕(同济大学附属上海市肺科医院)、谢博雄(同济大学附属上海市肺科医院)、谢冬(同济大学附属上海市肺科医院)、徐宁(安徽省胸科医院)、杨明磊(中国科学院大学宁波华美医院)、翟博(上海交通大学医学院附属仁济医院)、张翀(浙江大学医学院附属第一医院)、张雷(同济大学附属上海市肺科医院)、张磊(同济大学附属上海市肺科医院)、张莉萍(同济大学附属上海市肺科医院)、张鹏(同济大学附属上海市肺科医院)、张雪冬(南通市第六人民医院)、赵德平(同济大学附属上海市肺科医院)、赵国芳(中国科学院大学宁波华美医院)、赵晓刚(同济大学附属上海市肺科医院)、郑卉(同济大学附属上海市肺科医院)、周超(上海市胸科医院 )、周逸鸣(同济大学附属上海市肺科医院)、周永新(上海市同济医院)、朱余明(同济大学附属上海市肺科医院)
参考文献。
声明:本文来源中国胸心血管外科临床杂志,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。













