

我国恶性肿瘤发病占全球的23.9%,恶性肿瘤死亡占我国居民死亡的23.9%,恶性肿瘤是威胁我国人民健康的重大公共卫生问题。药物治疗是肿瘤治疗的主要手段,尤其是晚期肿瘤患者。临床试验既是最前沿的恶性肿瘤治疗方法,更是肿瘤药物上市的必经之路。在国际形势、国内政策、临床需求及经济发展等的驱动下,自2016年起,中国肿瘤药物临床试验蓬勃发展,以靶向药和免疫药为代表的大量创新药物进入试验及临床。2020年新型冠状病毒肺炎(COVID-19)的爆发给全球经济及医疗服务带来巨大挑战,也给全球大部分国家的临床试验运营造成了影响,尤其是肿瘤药物临床试验,其受试者免疫力差,感染风险高。在本研究中,我们基于国家食品药品监督管理总局药物临床试验登记与信息公示平台和国产药品及进口药品数据查询系统的数据,汇总了2020年我国肿瘤药物临床试验的最新进展及上市药物情况,并与2019年进行比较分析,旨在为利益相关方提供最新数据及决策证据,并探讨COVID-19对我国肿瘤药物临床试验的影响,揭示国内制药企业和全球制药企业在我国肿瘤药物研发中的布局差异。
资料与方法
1.资料来源和提取:
本研究的肿瘤药物临床试验资料来自国家食品药品监督管理总局药品审评中心建立的药物临床试验登记和信息公示平台(http://www.chinadrugtrials.org.cn/)登记数据库。2020年1月1日至2020年12月31日期间,共有2548项药物临床试验在该平台登记注册。在这2548项药物临床试验中,首先以"癌""瘤""化疗""白血病"作为关键词进行肿瘤药物临床试验初筛。然后,由2位主治医师独立进行人工复筛,若出现结果不一致,由1位主任医师裁定。为保证不遗漏肿瘤药物临床试验,从初筛排除的数据库中随机抽取20%的临床试验,再由2位主治医师核实。针对纳入的肿瘤药物临床试验,提取其项目基本信息、试验管理信息及试验科学信息,具体条目与既往研究相同。抗肿瘤药物的上市信息从国家食品药品监督管理总局国产及进口药品数据查询系统收集。
2.评价指标:
主要评价指标包括肿瘤药物临床试验数量、肿瘤药物临床试验占比、肿瘤试验药物数量及肿瘤上市药物数量。
3.统计学方法:
采用SAS 9.4软件进行统计分析。计数资料组间比较采用χ2检验,均为双侧检验,检验水准α=0.05。
结果
1.肿瘤药物临床试验情况
2020年我国登记注册的肿瘤药物临床试验为722项,比2019年增长了52.3%,占同期全部注册药物临床试验的28.3%(722/2548),与2019年的21.8%(474/2174)比较,差异有统计学意义(χ2=26.47,P<0.001)。在722项肿瘤药物临床试验中,国内制药企业发起的药物临床试验占大多数(603项,占83.5%),国内试验占主体(617项,占85.5%),试验分期以Ⅰ期最多(321项,占44.5%)。与2019年注册的肿瘤药物临床试验比较,在申办方、试验范围及试验分期的构成上均未见明显变化(均P>0.05,表1)。
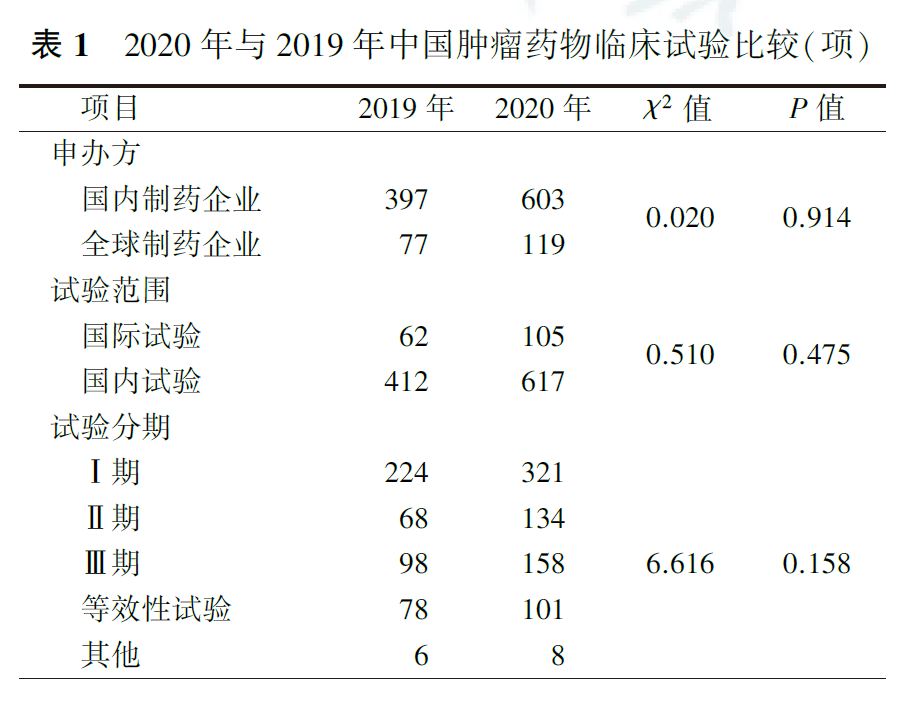
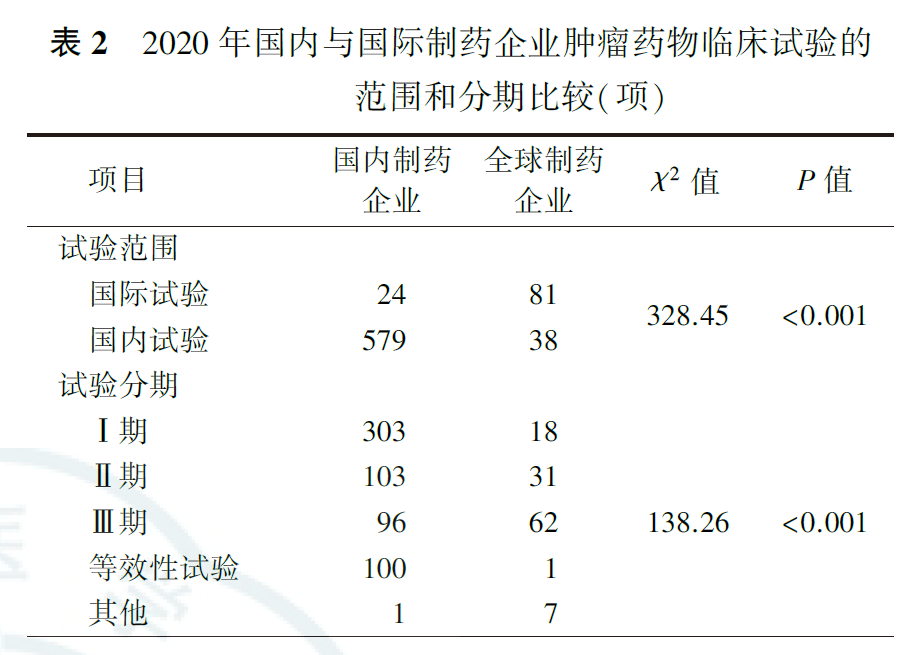
国内制药企业和全球制药企业发起的肿瘤药物临床试验比较显示,国内制药企业发起的国际多中心试验所占比例低于全球制药企业(分别为4.0%和68.1%,P<0.001),Ⅰ期临床试验和等效性试验所占比例高于全球制药企业(分别为50.2%和15.1%,16.6%和0.8%,均P<0.001;表2)。
除外以肿瘤辅助治疗为适应证者,其他药物临床试验均明确了适应证,共涉及27种肿瘤,居前10位的依次为实体瘤158项(21.9%),肺癌108项(15.0%),乳腺癌80项(11.1%),淋巴瘤74项(10.2%),肝癌44项(6.1%),白血病39项(5.4%),前列腺癌34项(4.7%)、食管癌18项(2.5%)、胃癌17项(2.4%)和结直肠癌17项(2.4%)。其后依次为膀胱癌和尿路上皮癌14项,宫颈癌13项,胰腺癌12项,多发性骨髓瘤12项,卵巢癌10项,黑色素瘤9项,胆管癌8项,头颈鳞癌8项,甲状腺癌5项,胶质母细胞瘤4项,胃肠道间质瘤3项,胸腺癌3项,肾癌3项,骨巨细胞瘤2项,神经纤维瘤2项,皮肤癌1项。
722项肿瘤药物临床试验共涉及118家牵头单位,比2019年增加了10家。其中牵头临床试验数量居前10位的单位依次为中国医学科学院肿瘤医院(64项)、北京肿瘤医院(61项)、复旦大学附属肿瘤医院(52项)、中山大学附属肿瘤医院(48项)、上海市东方医院(30项)、四川大学华西医院(24项)、中国医学科学院血液病医院(23项)、解放军总医院第五医学中心(22项)、天津市肿瘤医院(20项)和上海胸科医院(18项)。这10家单位牵头的肿瘤药物临床试验共362项,占2020年肿瘤药物临床试验总数的50.1%。
2.肿瘤药物临床试验所涉及的药物情况
722项肿瘤药物临床试验共涉及458种抗肿瘤试验药物,比2019年增长了36.7%。其中原研药是常见的药物类型(77.1%),肿瘤治疗药物多见(92.8%)。作用机制方面,以靶向药为主(76.6%),其次为免疫药(22.9%)。从申办方来看,393种(85.8%)试验药物由国内制药企业开发,65种(14.2%)由全球制药企业开发。与2019年比较,在药物类型、药物作用、作用机制及申办方的构成上均未见明显变化(均P>0.05,表3)。
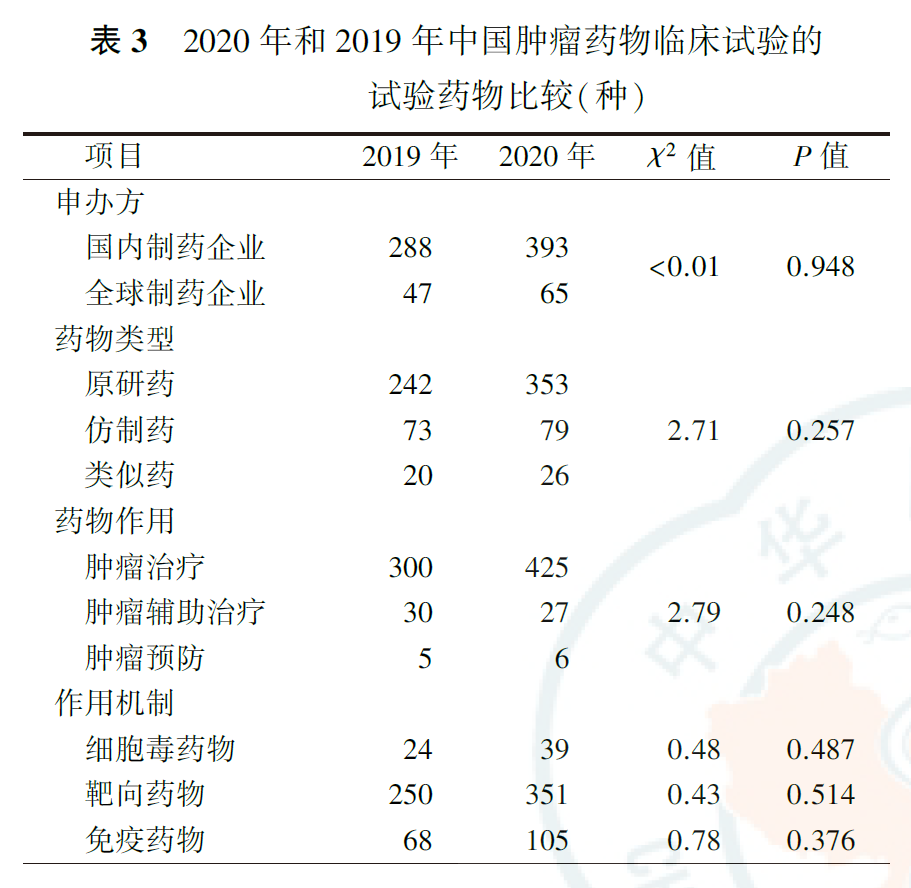
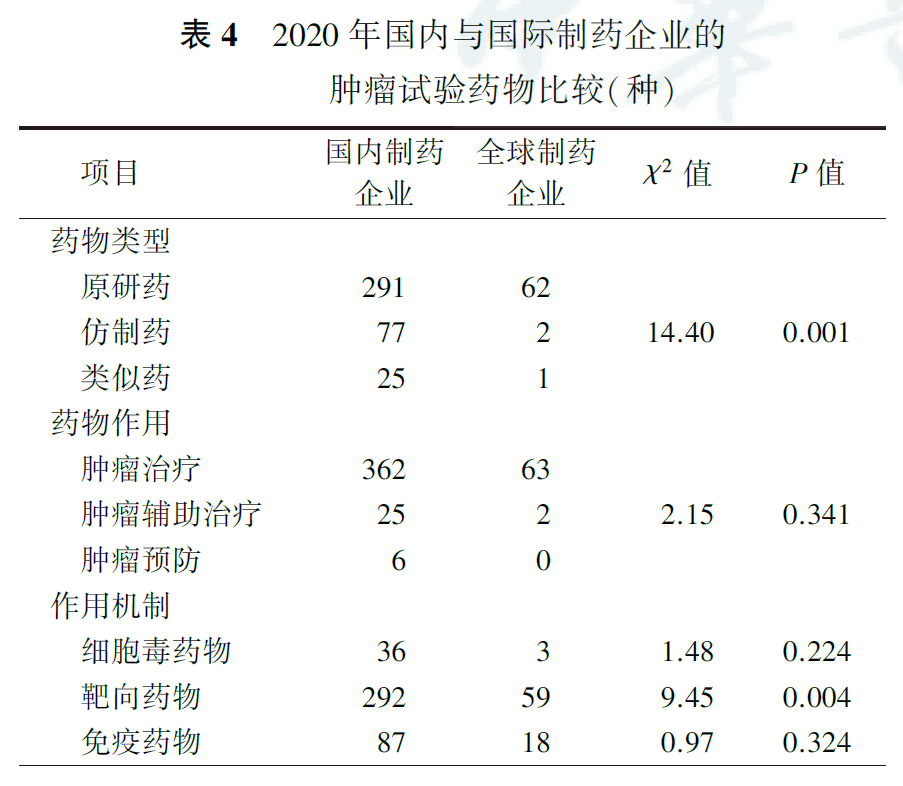
国内制药企业和全球制药企业发起的肿瘤药物临床试验比较显示,2020年国内制药企业研发的肿瘤试验药物中,原研药占74.0%,低于全球制药企业的95.4%(P=0.001);靶向药物占74.3%,低于全球制药企业的90.8%(P=0.004)。在药物作用、细胞毒药物和免疫药物作用机制方面,国内制药企业和全球制药企业差异无统计学意义(均P>0.05,表4)。
3.原研靶向药靶点分布概况
2020年中国肿瘤药物临床试验的试验药物中,靶向新药共有295种,比2019年的199种增长了48.2%。涉及靶点广泛,超过100余种,其中双靶点或多靶点药物为54种(18.3%),与2019年的22.6%比较,差异无统计学意义(χ2=1.37, P=0.241)。涉及试验药物超过10种的靶点共有4个,与2019年相同,依次为程序性死亡蛋白1(programmed death-1, PD-1)24种,表皮生长因子受体(epidermal growth factorreceptor, EGFR)21种,程序性死亡配体1(programmed death-ligand 1, PD-L1)13种,人表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2)13种。
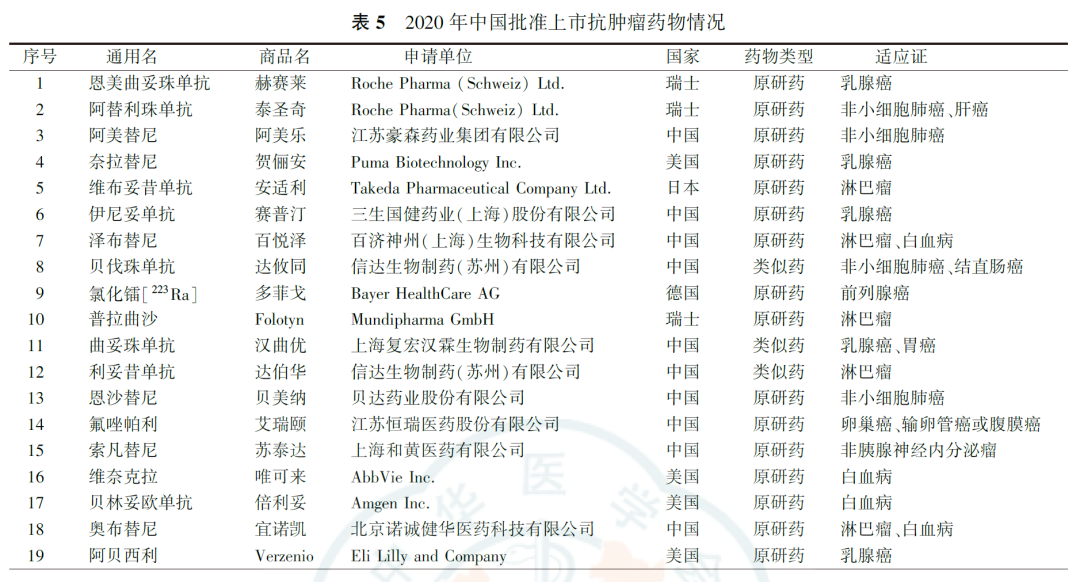
4.上市抗肿瘤药物情况
2020年共有17家制药企业(国内制药企业9家,全球制药企业8家)的19种抗肿瘤药在中国获准上市(表5)。获批品种均为肿瘤治疗药物,包括16种原研药,3种生物类似药。作用机制方面,氯化镭为核素新药,普拉曲沙为化疗新药,贝林妥欧单抗和阿替利珠单抗既是靶向药也是免疫药,其他均为靶向药。在获批适应证方面,共涉及12种肿瘤,其中获准用于治疗乳腺癌5种,用于治疗非小细胞肺癌、白血病和淋巴瘤各4种,用于治疗其他肿瘤的药物均为1种。
讨论
为保障公众知情权,发挥社会监督作用,促进试验质量和效率的提高以及服务于技术审评和监督检查等药品监管工作,国家食品药品监督管理总局药品审评中心建立了药物临床试验登记和信息公示平台,并强制要求,自2013年起,凡获国家食品药品监督管理总局临床试验批件并在我国开展的临床试验研究,包括生物等效性试验、PK试验及Ⅰ、Ⅱ、Ⅲ、Ⅳ期临床试验等,均要在该平台进行登记和信息公示。本研究的药物临床试验进展资料即来自该权威平台数据库。研究结果显示,虽然2020年疫情防控形势严峻,但我国肿瘤药物临床试验的开展并未受影响,仍处于蓬勃发展期。肿瘤药物临床试验数量占全年药物临床试验的28.3%,肿瘤药物临床试验数量、涉及肿瘤试验药物数量与2019年相比均保持高水平增长,增长率分别为52.3%和36.7%,高于全球肿瘤免疫临床试验22%的增速。这既与我国较大的肿瘤临床治疗需求有关,也与在疫情防控不放松前提下,我国全力复工复产,各临床试验机构积极响应,及时发布针对疫情特殊时期相关工作流程变更指导原则有关。
与2019年的情况类似,本研究结果也显示,2020年国内制药企业已经成为我国肿瘤药物研发的中坚力量,83.5%的肿瘤药物临床试验由国内制药企业发起,85.8%的肿瘤试验药物由国内制药企业开发。2020年国内制药企业在抗肿瘤自主创新药物方面也取得一系列关键性突破。阿美替尼是首个获批的第3代EGFR酪氨酸激酶抑制剂自主创新药;泽布替尼是首个获批的国产Bruton酪氨酸激酶抑制剂,实现了中国创新药在中美两地同步开发并且均成功获批上市零的突破;恩沙替尼是首个获批的间变性淋巴瘤激酶自主创新药;氟唑帕利是首个获批的国产聚腺苷二鳞酸核糖聚合酶抑制剂。另外,我国自主研发的生物类似药曲妥珠单抗是首个在中国和欧盟同步获批的药物。
免疫治疗已成为很多瘤种的标准治疗。有研究表明,我国肿瘤患者免疫靶点分布较为集中,其中PD-1和PD-L1最多,占所有肿瘤免疫管线的76%。从2020年研发管线看,目前我国PD-1和PD-L1临床试验仍在增长,且以国内制药企业为主。我国已有6种PD-1药物和2种PD-L1药物获批。2020年医保谈判,江苏恒瑞医药有限公司的艾瑞卡以超过80%的价格降幅进入医保。以上现状再次提示PD-1产品重复冗余的问题突出,我国免疫药物的自主研发有必要调整策略,探索更多免疫调节机制,真正在靶点方面寻求突破,实现差异化竞争。
与2019年相比,2020年肿瘤药物临床试验的申办方分布、试验范围分布和试验分期分布,及试验药物申办方分布、药物类型分布、药物作用分布及作用机制分布均未发生明显变化。全球制药企业在我国发起的肿瘤药物临床试验仍以大规模确证性试验为主,早期探索性试验较少,促进全球制药企业更早地将中国市场纳入全球肿瘤药物临床试验战略布局仍然是未来重要的努力方向。不论从注册试验适应证情况,还是今年上市新药获批适应证情况来看,肺癌、乳腺癌和淋巴瘤均是药物研发的热门瘤种。相对来说,针对我国肝癌、食管癌及胃癌等特色肿瘤及罕见肿瘤的药物研究或上市药物仍然较为匮乏。
受限于数据的可获得性,本研究存在一些局限性,包括未纳入研究者发起研究和正在进行的肿瘤药物临床试验,未能与其他国家的肿瘤药物临床试验状况进行比较。此外,本研究主要是从已注册的药物临床试验和上市药物数量方面,评价疫情影响下全年中国肿瘤药物临床试验的发展情况,未能从临床试验实际运营,包括立项、伦理审核、患者入组、患者用药和随访等实际操作层面,评价疫情对中国肿瘤药物临床试验研究的影响。
总之,我们基于国家权威数据库的资料,对2020年我国肿瘤药物临床试验及上市肿瘤药物情况进行了系统分析。2020年,我国肿瘤药物临床试验数量及试验药物数量并未受疫情影响,仍保持着高水平增长。国内制药企业作为我国肿瘤药物临床试验的中坚力量,在2020年取得了一系列关键性成果。加强中国特色肿瘤药物研发投入,促进中国更早融入到全球肿瘤药物研发体系,仍是未来重要的努力方向。
声明:本文来源中华肿瘤杂志,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。













