近年来,随着胃癌规范化手术的实施、辅助/新辅助治疗(化疗、放疗)的开展以及靶向治疗、免疫治疗药物的进步,我国胃癌患者5年生存率有了一定的提高。目前,胃癌治疗理念已从过去单纯手术为主的外科治疗,过渡为在多学科协作基础上,以手术为主的综合治疗,其病理诊断也持续不断的更新迭代中。
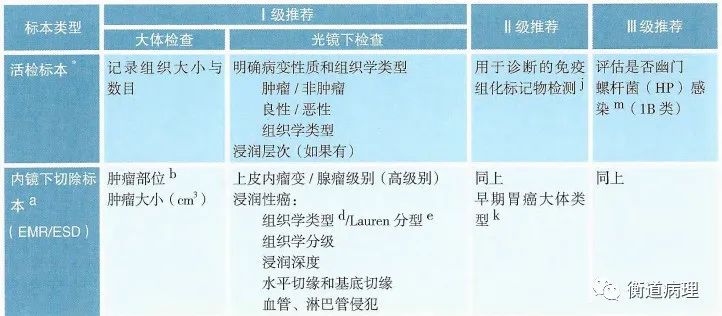
胃癌治疗前基本诊断手段主要包括内镜和影像学检查,用于胃癌的定性诊断、定位诊断和分期诊断。其他还包括体格检查、实验室检查、内镜(超声内镜和细针穿刺)、转移灶活检,以及诊断性腹腔镜探查和腹腔灌洗液评价。
胸腹盆部CT检查是治疗前分期的基本手段,MRI、腹腔镜探查及PET分别作为CT疑诊肝转移、腹膜转移及全身转移时的备选手段。影像学报告应提供涉及cTNM分期的征象描述,并给出分期意见。
内镜活检组织病理学诊断是胃癌确诊和治疗的依据。胃癌术后系统组织病理学诊断(pTNM分期)为明确胃癌的组织学类型、全面评估胃癌病情进展、判断患者预后、制订有针对性的个体化治疗方案提供必要的组织病理学依据。目前以肿瘤组织HER2表达状态为依据的胃癌分子分型是选择抗HER2靶向药物治疗的依据,所有经病理诊断证实为胃或食管胃结合部腺癌的病例均有必要进行HER2检测。推荐胃癌组织中评估MSI/dMMR状态。二代测序(NGS)和液体活检等在胃癌的应用处在探索和数据积累阶段。
当活检无法取得确诊时,刷片或灌洗液细胞学检测可用于确认是否存在肿瘤;不能手术的晚期胃癌的腹水或胸腔积液脱落细胞学检查、远处转移病灶活检等应按照相应临床病理常规进行处理与诊断;有条件的单位推荐使用标准化的病理报告模板,有助于诊断规范化与后续临床分析。
内镜切除(EMR/ESD)已成为早期胃癌有效的治疗策略。EMR/ESD标本应由内镜或手术医师充分展开、于木板或泡沫板上进行钉板固定。按2-3mm间隔并垂直于黏膜面进行全部取材、制片观察。
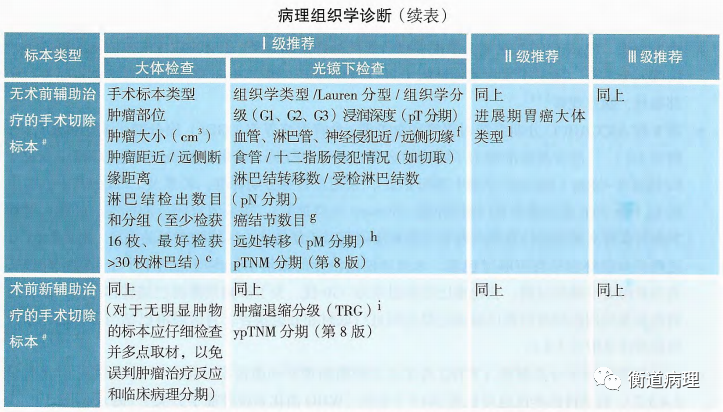
第8版AJCC/UICC分期系统对胃癌和食管癌/食管胃交界部(GEJ)癌分期的分期标准做出了明确的定义:对于GEJ癌,若肿瘤侵及EJ线且肿瘤中心位于EJ线以下<2cm(Siewert分型Ⅰ型和Ⅱ型),采用食管癌分期标准;若累及EJ线但其中心位于EJ以下≥2cm或未累及EJ线的肿瘤(Siewert分型Ⅲ型),则采用胃癌分期标准。因此,准确判断胃食管交界线的位置及其是否受到肿瘤侵犯对于评估这一区域肿瘤至关重要。
送检的分组淋巴结均应取材包埋,未经新辅助治疗的根治术标本应检出不少于16枚淋巴结,若为获得更准确的分期,获检淋巴结数量最好>30枚。为了准确判断淋巴结转移范围,推荐外科医师及病理医师按照胃区域淋巴结进行分组取材和分组报告。
Lauren分型根据胃癌组织学生长方式将胃腺癌分为肠型、弥漫型、混合型。肠型:肿瘤主要由高至中分化的异型腺体组成,有时在肿瘤浸润前缘可呈现低分化。弥漫型:肿瘤由黏附性差的细胞组成,广泛浸润胃壁,很少或没有腺体形成。混合性:含有大致相同数量的肠型与弥漫型的胃癌。
本指南推荐采用距切缘1mm内见癌细胞定义为切缘阳性。
原发灶相邻的浆膜下癌结节,虽然无残留淋巴结组织结构,仍被认为是区域淋巴结转移。推荐对区域转移性淋巴结和癌结节进行分别记录。
胃癌局部或区域之外的部位获取、经病理证实的转移性病灶被视为远处转移(pM1):包括手术切除的远处站点淋巴结以及其他器官组织中见癌细胞累及(如腹腔灌洗液或腹膜种植结节)。
肿瘤退缩分级(TRG)的病理学评估根据肿瘤细胞残留及纤维化程度进行分级,推荐使用AJCC第八版/NCCN指南的分级系统。第8版胃癌分期提出了采用ypTNM 表示新辅助治疗后手术病理分期。
病理诊断困难时,可根据胃肿瘤的诊断与鉴别诊断、预后评估及治疗等需要选择胃癌诊断相关标记物检测。
早期胃癌:癌组织局限于黏膜内及黏膜下层,不论是否伴有区域淋巴结转移。
进展期胃癌指癌组织侵犯胃壁固有肌层或穿透肌层达浆膜层者。进展期胃癌可根据Borrmann分型将大体形态分为4种类型。Borrmann Ⅰ型:结节隆起型;Ⅱ型:局限溃疡型;Ⅲ型:浸润溃疡型;Ⅳ型:弥漫浸润性(局部Bor. Ⅳ,革囊胃)。
胃幽门螺杆菌(Hp)感染状态是第8版胃癌分期要求登记的项目之一。具备条件的医疗单位应对胃癌患者的Hp状态进行评估并登记。
对于标准治疗失败的晚期胃癌患者可以进行二代测序(NGS)检测寻找潜在的治疗靶点。强调使用获得认证的平台和产品,采取严格的质量控制和规范的操作流程,确保结果的可靠性。
HER2阳性晚期胃癌患者可从抗HER2治疗中获益,HER2状态可预测晚期胃癌患者对曲妥珠单抗治疗的反应和生存获益,应当对所有胃癌进行HER2状态检测。
据文献报道,基于血液中ctDNA靶向测序的HER2基因体细胞拷贝数结果与荧光原位杂交数据高度一致,对于无法取得活检组织的患者,液体活检HER2扩增情况是一种可能的有效补充手段。基于ctDNA的HER2扩增情况还可用于胃癌患者曲妥珠单抗治疗反应的监测。
HER2的免疫组化(IHC)和原位杂交(in situ hybridzation, ISH)检测全程应严格按照胃癌HER2检测指南(2016版)建议的操作规范执行,相关检测(IHC、FISH/ DSISH)应选用中国国家药品监督管理局批准的试剂盒 。
针对程序性死亡受体-1(programmed death receptor 1, PD-1)及其配体-1(programmed death ligand 1, PD-L1)的免疫检查点抑制剂疗法是近年肿瘤免疫治疗的研发热点。对临床上拟采用PD-1/PD-L1抑制剂治疗的胃癌患者,推荐评估微卫星不稳定(microsatellite instability, MSI)/错配修复缺陷(mismatch repair, MMR)状态、PD-L1表达与肿瘤TMB,EBV对于免疫治疗的疗效预测价值有争议。
错配修复(MMR)蛋白检测:免疫组化方法检测MLH1、PMS2、MSH2、MSH6等4个蛋白表达,阳性定位于细胞核,任何一个蛋白表达缺失评价为dMMR(错配修复功能缺陷),所有4 个蛋白表达均阳性为pMMR(错配修复功能完整)。
微卫星不稳定(MSI):建议采用美国国家癌症研究院(NCI)推荐的5个微卫星检测位点(BAT25、BAT26、D5S346、D2S123、D17S250)。评判标准为三级:所有5个位点均稳定为微卫星稳定(MSS),1个位点不稳定为微卫星低度不稳定(MSI-L),2个及2个以上位点不稳定为微卫星高度不稳定(MSI-H)。MSI多由MMR基因突变及功能缺陷导致,也可以通过检测MMR蛋白缺失来反映MSI状态。一般而言,dMMR相当于MSI-H,pMMR相当于MSI-L或 MSS。
适合进行PD-L1检测标本中的肿瘤细胞必须至少100个。CPS=PD-L1染色细胞(包括肿瘤细胞、巨噬细胞与淋巴细胞)的总数/镜下肿瘤细胞总数(×100)。
FDA授权批准了针对NTRK基因融合阳性的实体瘤患者使用TRK抑制剂靶向治疗(如larotrectinib或entrectinib)。对于标准治疗失败的胃癌患者可以进行NTRK基因融合检测, NTRK基因融合可以使用多种方法进行检测,免疫组化方法是一种快速、方便的初筛手段,但仍需要应用FISH或NGS进行验证。
-----------END--------------
声明:本文来源于衡道病理。