
1. 血管因素——血管内皮细胞损伤
2. 血液理化性质的改变——血液凝固性增高
血小板激活后有助于凝血酶的形成;
血小板通过释放纤溶酶原激活物抑制剂有利于血栓的形成和稳定;
血小板形成的因子可使内皮细胞表面失去抗凝活性。
3. 血液流变学改变——血流缓慢、涡流形成
血流速度在全身或局部减慢、在局部形成涡流均可促进血栓形成及凝血。
动脉粥样硬化、感染、炎症、吸烟、高脂血症等均可导致血管壁损伤,引起血小板聚集及启动凝血与纤溶系统。
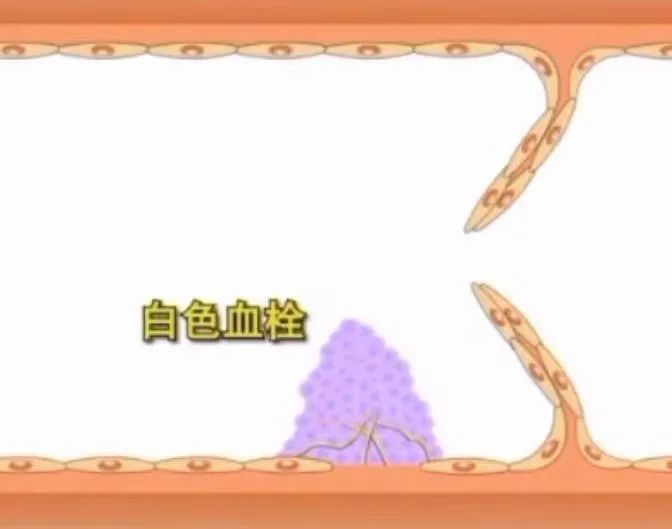
1.白色血栓(血栓头部)
静脉内膜损伤处最初沉积并吸引更多血小板粘附,血小板间有少量纤维素,形成白色较坚实的固体块状物质。牢固地粘附在内膜损伤处的表面。
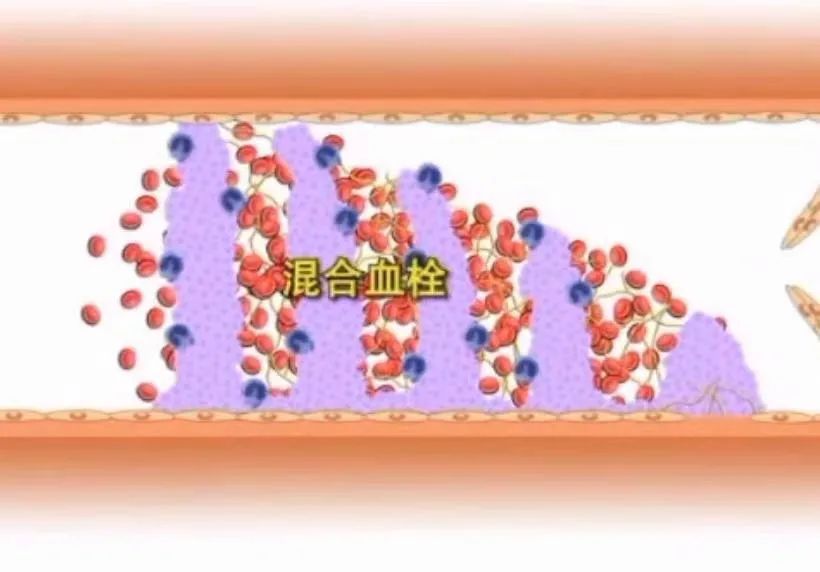
2.混合血栓(血栓体部)
在白色血栓的下游,血流形成漩涡,流速减慢,血小板沉积并相互吻合呈分支的珊瑚状,镜下呈分支状的小梁,小梁表面有白细胞大量粘着,小梁之间因血流更趋缓慢,使凝血因子能达到较大浓度而有多量纤维素形成,构成网状,网眼内粘有红细胞及少量白细胞,这样形成的圆柱状血栓,肉眼呈红白交替的层状,成为混合血栓。
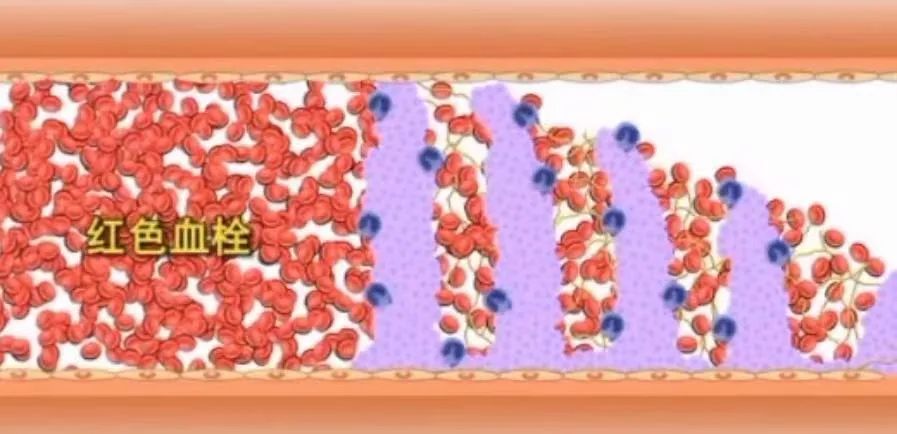
3.红色血栓(血栓尾部)
混合血栓的下游,血流极为缓慢甚至停止,出现血液凝固过程,纤维素网眼内充填按正常比例均匀分布的红、白细胞,肉眼呈暗红色,光滑湿润而有弹性,以后水分吸收,变得干燥易碎。
4.透明血栓
在弥漫性血管内凝血时(DIC),微循环内形成由纤维素构成的纤维素性血栓,嗜酸性,均质透明,又称透明血栓,因其在微循环内;亦称微血栓。
1. 血管内膜粗糙,血小板粘集成堆,使局部血流形成漩涡

2. 血小板继续粘集形成多数小梁,小梁周围有白细胞粘附

3. 小梁间形成纤维素网,网眼中充满红细胞

4. 血管腔阻塞,局部血流停滞,停滞之血液凝固

1. 动脉血栓形成
由于动脉血压高、流速快,快速流动的凝血因子难以相互作用,因此动脉内的凝血过程依赖于血小板所提供的反应平台,因此血小板在动脉血栓形成的过程中发挥着重要作用
在动脉粥样硬化斑块破裂时,血小板在局部聚集形成白色血栓,同时,凝血因子被组织因子激活而诱发凝血瀑布反应,在反应初期,局部形成的凝血酶不断被血流冲走,不易在局部形成高浓度的凝血酶,故亦不易形成红色血栓,随着白色血栓的不断增大,局部血流减缓并在白色血栓远端形成湍流,在白色血栓的远心端形成高浓度凝血酶,其将可溶性纤维蛋白原转变为不溶的纤维蛋白,纤维蛋白网络血细胞形成红色血栓,因此动脉血栓的头部为白色血栓,尾部为红色血栓。
2. 静脉血栓形成
静脉血流速度缓慢,凝血酶及其他凝血因子容易在局部聚集形成高浓度,并易于黏附,故静脉血栓主要由凝血酶降解纤维蛋白原生成纤维蛋白,纤维蛋白再网络血细胞构成混合血栓。
先天性抗凝血酶缺乏、蛋白C缺乏、蛋白S缺乏、恶性肿瘤、先天性心脏病、口服避孕药、肾病综合征和抗凝脂抗体综合征、长期卧床、大手术后、肥胖和静脉曲张均是静脉血栓形成的因素。
由于静脉血流速度慢,高凝和高黏的个体容易在静脉形成高浓度的凝血酶,进而促成由纤维蛋白网络血细胞形成红色血栓。
3. 微血管血栓形成
可由于微血管内皮细胞表达组织因子或血循环中出现促凝物质,也可由于血小板激活后形成聚集体。
在微血管内形成透明栓或细胞栓,形成后常导致器官功能衰竭。
4. 心房的血栓形成
心房纤颤由于血流紊乱、形成涡流以激活凝血过程而发生红色血栓。
动脉系统的血栓形成主要由内皮损伤启动,血小板的激活及相互交联是其基本病理生理过程,故动脉系统的抗栓主要针对抗血小板;血栓体尾部形成则需凝血酶的参与,在动脉血栓性疾病的急性或特殊状态下,要同时辅助使用抗凝药,才能达到更好的抗栓效果。
在血流速度慢的静脉、动脉的涡流处、发生房颤的心房等处,凝血酶容易聚集形成高浓度,并进一步催化纤维蛋白原形成纤维蛋白,纤维蛋白网络血细胞形成红色血栓,故在这些情况下应主要使用抗凝药防止血栓的形成。













