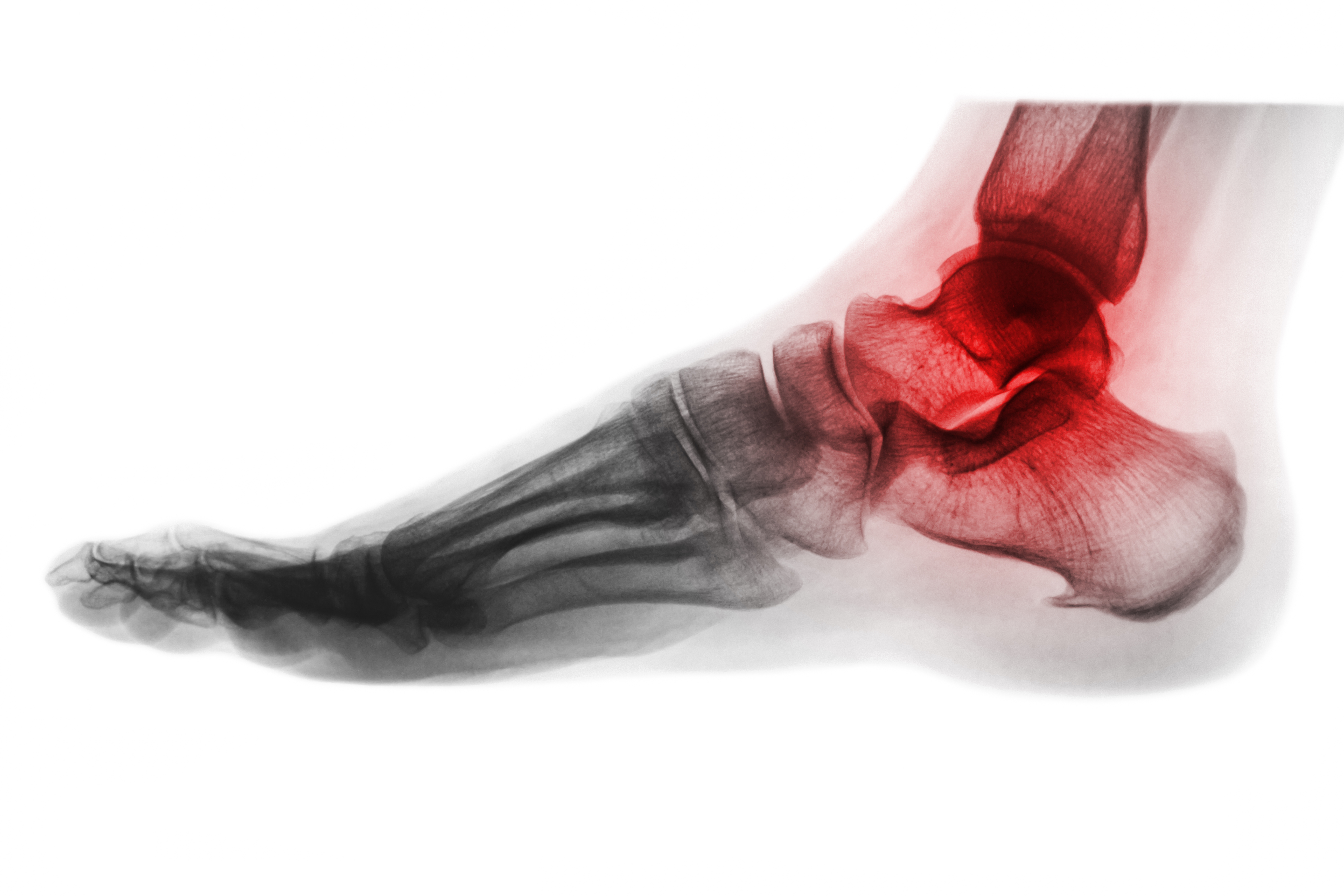
神经病理性疼痛 (neuropathic pain, NP) 是由体感觉系统损伤或疾病导致的疼痛 [1],分为周围神经病理性疼痛和中枢神经病理性疼痛 [2],临床上周围神经病理性疼痛较常见。
NP 不是单一疾病,而是由许多不同疾病和损害引起的综合征,表现为一系列症状和体征,涵盖了100 多种临床疾病 [1,2],严重影响病人生活质量 [2]。由于神经病理性疼痛的机制复杂,导致临床上慢性NP 病人的治疗不充分,甚至出现不恰当的治疗 [2]。
为规范周围神经病理性疼痛的诊断和治疗,中国医师协会疼痛科医师分会、国家临床重点专科·中日医院疼痛专科医联体和北京市疼痛治疗质量控制改进中心组织国内专家多次研讨,在参考借鉴国外最新指南、广泛收集临床证据的同时,结合临床经验和中国国情,制定了《周围神经病理性疼痛诊疗中国专家共识》。
由于在临床实践中NP 病人存在独特性和差异性,未必完全与共识建议的情况一致,故医务人员在实际工作中可将本共识建议作为参考,根据病人个体情况进行独立判断和诊疗。
一、定义及分类
国际疼痛学会 (International Association for theStudy of Pain, IASP) 将神经病理性疼痛 (neuropathicpain, NP) 定义为:“由躯体感觉系统的损伤或者疾病而导致的疼痛” (pain caused by a lesion or diseaseof the somatosensory nervous system) [1]。基于损伤或者疾病的解剖位置可以分为周围神经病理性疼痛 (peripherally-induced neuropathic pain, pNP) 和中枢神经病理性疼痛 [2]。周围神经病理性疼痛在临床中较常见,由周围神经损害而导致pNP 的常见病因及综合征见表1 [3~5]。
二、流行病学和卫生经济学数据
随着人口老龄化,pNP 的发病率逐年增加。不同疾病导致的pNP 的发病率各不相同。痛性糖尿病周围神经病变 (painful diabetic peripheral neuropathy, PDPN) 是糖尿病最常见的慢性并发症。16% 的糖尿病病人受其影响,许多病人未被诊断(12.5%) 和未经治疗(39%) [6]。2013 年,我国2型糖尿病患病率高达10.4% [7],据此推算,约2200万病人受PDPN 困扰。带状疱疹后神经痛 (postherpetic neuralgia, PHN)也是常见的一种pNP,年发病率为3.9~42.0/10 万 [8]。9%~34% 的带状疱疹病人会发生PHN [8]。我国城市医院皮肤科、神经科和疼痛科就诊≥ 40 岁病人中,带状疱疹的总体患病率为7.7%,PHN 的总体患病率为2.3%,两者患病率均有随年龄增加而逐渐升高的趋势 [9]。
三叉神经痛是临床常见的颅神经疾病,患病率为182 人/10 万,年发病率为3~5/10 万,多发生于成年及老年人,高峰年龄在48~59 岁 [10]。化疗诱发的周围神经病变 (chemotherapy induced peripheral neuropathy, CIPN) 是一种常见的治疗相关并发症,长期影响病人的生活质量。在使用多种药物治疗的病人中, CIPN 的总发病率约为38%,因化疗方案、暴露时间和评估方法而异[11]。
术后慢性疼痛的发生率因手术种类不同差异较大, 据报道在10%~50% 之间 [12]。截肢、开胸术和冠状动脉旁路术后的发生率最高,可达30%~50% [12]。NP 常与睡眠障碍、焦虑、抑郁相关,严重影响病人生活质量,给社会带来巨大的经济负担 [5,13]。以我国PHN 病人为例,每位病人因PHN 年均自付费用达16 873 元,因生产力损失年均间接损失达28 025 元 [14]。
三、机制
NP 的发病机制复杂,包括组织、细胞结构改变和功能异常。常见的机制包括离子通道改变、外周敏化、中枢敏化、下行抑制系统功能降低、神经胶质细胞活化等 [15]。
(一)离子通道改变
周围神经损伤可以诱发神经系统离子通道(如钠、钙和钾离子通道)发生改变,导致神经对传导信号表达异常,引起NP [5]。如钙通道α2δ-1 亚单位在周围感觉神经损伤导致的慢性NP 中起着重要的作用 [16];Nav 1.3、Nav 1.7 和Nav 1.8 等离子通道异常可能会降低刺激阈,并引起异位放电,导致自发性疼痛 [17]。
(二)外周敏化和中枢敏化
外周敏化 [17]:周围神经损伤后诱发炎症并启动修复过程,导致神经超兴奋状态称为外周敏化。在大多数病人中,敏化随着损伤愈合和炎症的消退而消失,当持续伤害或疾病(如糖尿病)的反复刺激导致伤害持续时,初级传入神经元的超兴奋性变化可能会持久。降钙素基因相关肽、P 物质、前列腺素、缓激肽、生长因子和细胞因子等多种物质能致敏伤害感受器,导致外周敏化。
中枢敏化:中枢神经系统伤害性神经元对传入的反应增强称为中枢敏化 [18]。经过反复或足够强烈的刺激,脊髓和脊髓上区域的伤害性通路可对随后的刺激变得敏感 [4]。这种反应性的增强涉及多方面复杂因素:如钙渗透性改变、受体过表达和突触可塑性的变化;小胶质细胞激活,触发TNF-α, IL-1β,IL-6, BDNF 和蛋白酶等促疼痛介质释放;皮质下和皮质神经元可塑性变化等 [4]。
(三)下行抑制系统功能降低
周围神经发生损伤病变导致pNP 后,病程持续时间长,临床表现复杂,如感觉受损、运动障碍、自主神经功能紊乱,相应的神经支配区域的疼痛症状,疼痛可为自发性、持续性疼痛或阵发性疼痛 [19~22]。
此外,病人可出现肌肉痉挛、僵硬、无力和萎缩等症状 [21]。查体可见肌张力下降、肌肉萎缩以及腱反射的减弱、消失、感觉异常等。即使原有病因去除、损伤愈合或得到有效控制,但疼痛仍迁延持续,严重影响病人生存质量,并伴发情感障碍。pNP 的共同临床特征如下:
(一)自发性疼痛 (spontaneous pain)
是指机体无任何外界刺激而出现的疼痛症状,可在神经损伤后数天或数周内发生,当一条周围神经损伤时,疼痛部位与神经干的解剖部位相一致 [19,20]。中枢神经损伤的疼痛部位较为弥散、范围广,表现为对侧躯体的头面部、躯干或肢体的疼痛,且肢体远端疼痛重于近端。疼痛可表现为刀割样痛、闪电样痛、火烧样痛、撕裂样痛、穿击样痛、牵扯样痛、麻刺痛、射击痛、放射痛、麻木痛、电击样痛、针刺痛、紧箍痛、跳痛、冰冻痛等,表现各异,可为深在的或表浅的,多出现两种以上的疼痛性质。随活动、疲劳、精神紧张、环境或气候改变而加重。
(二)痛觉超敏 (allodynia)
即非痛刺激(如轻微羽毛刺激)所引起的疼痛 [5,22~24]。神经损伤的病人往往表现出痛觉超敏(或称触诱发痛),如轻微的接触或抚摸皮肤、床单、衣物轻触、风吹、震动等均可诱发疼痛,因此疼痛局部不能触碰,病人常佩戴自制护垫保护疼痛区域,甚至出现不能穿衣、保持免痛姿势的情况。
(三)痛觉过敏 (hyperalgesia)
是指对正常致痛刺激所引起的疼痛感增强,是由组织损伤后痛阈降低所致,出现疼痛程度被夸大的情况。物理检查显示对刺激反应的增强 [5,19],如冷热刺激、针刺可导致明显的剧烈疼痛。
(四)感觉异常 (paresthesia)
pNP 主要依赖于详尽的病史、系统的体格检查及必要的神经电生理等相关辅助检查明确诊断,但目前尚无统一诊断标准。
目前主要采用的是IASP 有关pNP 分级诊断标准 [25]。诊断标准为:
①疼痛区域符合躯体感觉神经的解剖分布;
②病史提示周围感觉系统存在相关损害或疾病;
③神经系统检查证实疼痛分布区域至少存在1 项体征与神经损害或疾病相关;
④至少1 项辅助检查证实躯体感觉系统存在相关损害或疾病。
同时符合上述①~④项标准,可确诊为NP;符合上述①、②、③或①、②、④标准,为很可能的神经病理性疼痛;符合上述第①和②项标准,但缺乏体征及辅助检查的证据,为可能的NP。
临床常用不同的神经病理性疼痛筛查量表快速筛查出NP,如ID疼痛量表、 DN4 量表、LANSS量表来鉴别NP 与伤害感受性疼痛。宜采用LANSS量表、ID pain 中文翻译版[26]。对筛选出的可疑NP,应采用相应的检查明确与疼痛相关的躯体感觉神经损伤或疾病。相应检查包括:血、尿液、粪便、脑脊液常规及生化、血糖、微生物、免疫学检查、毒物检测、神经生理检查、神经影像学检查、功能MRI 检查等以及皮肤活检等 [15]。
(一)治疗原则
pNP 的治疗原则为:
①早期干预、积极对因治疗;
②有效缓解疼痛及伴随症状、恢复机体功能、提高生活质量、降低复发率、促进神经修复;
③药物是最基础、最常用的治疗手段;
④药物治疗效果不理想或疼痛控制不满意的病人可采取微创介入、神经调控、手术等治疗手段;
⑤配合康复、心理、物理等多种手段,采取多模式综合治疗 [15,27,28]。
(二)药物治疗
1. 治疗原则
药物是pNP 目前主要治疗手段,应建立在保证睡眠、稳定情绪的基础上,并认真评估疼痛性质、治疗前后的症状体征和治疗反应 [15]。药物治疗的目的不仅要缓解疼痛,同时也要治疗抑郁、焦虑、睡眠障碍等共患病。停药应建立在有效、稳定治疗效果的基础上并采取逐步减量的方法 [15]。药物的选择应依据诊断,按药物作用机制选择药物,同时考虑药物的疗效、安全性(如药物代谢途径及对肝肾功能的影响等)和病人的临床情况(如并发症、禁忌证、合并用药中的药物相互作用等),采取个体化治疗 [15]。临床上常针对pNP 的病理特点联合用药 [15]。
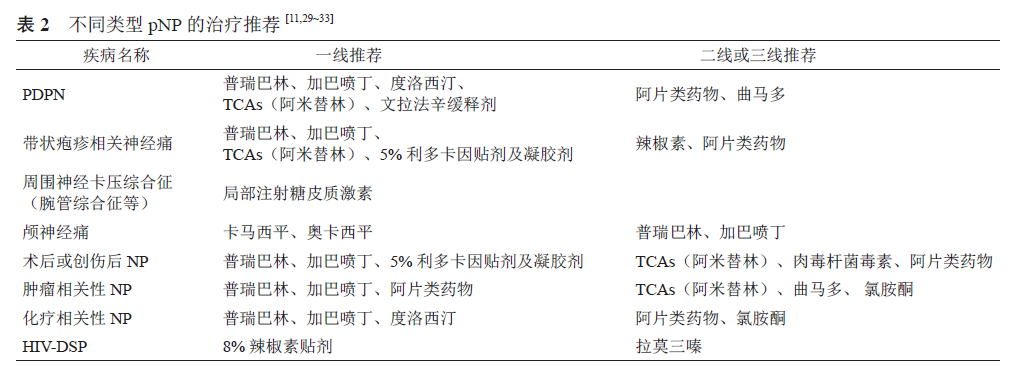
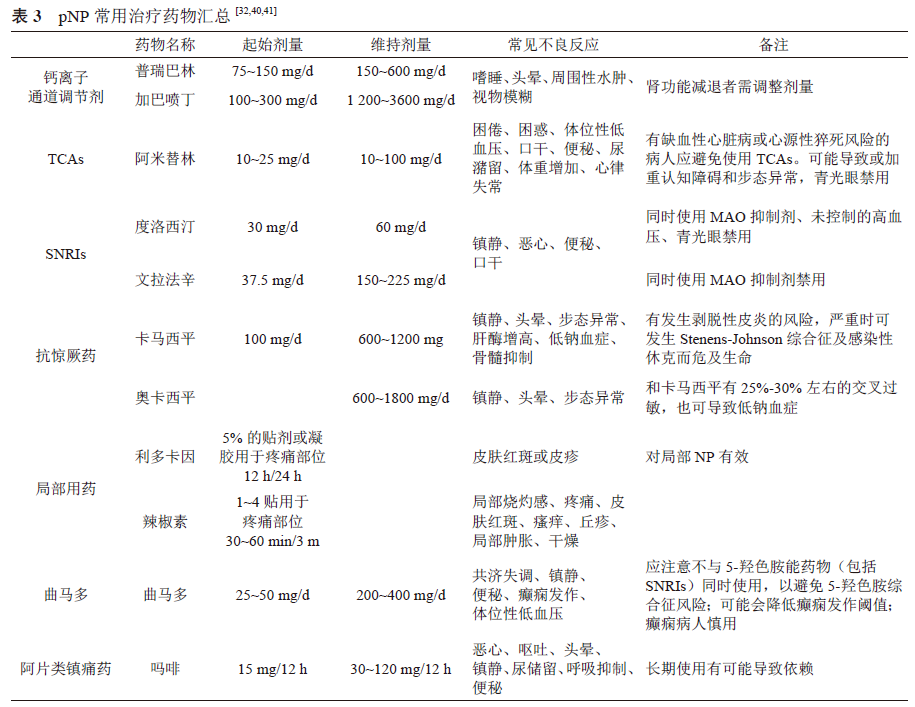
2. 常用治疗药物(见表2、3)
(1)抗惊厥药:
①钙离子通道调节剂:主要包括加巴喷丁和普瑞巴林,作用机制为调节电压门控钙通道α2-δ 亚基,减轻疼痛同时也可改善睡眠和情绪。药物的吸收受食物影响较小,不与血浆蛋白结合,基本不经肝脏代谢,没有重要的临床药物相互作用 [15]。普瑞巴林是第二代钙离子通道调节剂,与加巴喷丁相比,增强了与α2-δ 亚基的亲和力,滴定和起效更快,呈线性药代动力学特征,生物利用度≥ 90% 且与剂量无关 [34,35]。加巴喷丁需要数周缓慢滴定至有效剂量,呈非线性药物代谢动力学特征,生物利用度随剂量升高而降低 [34,35]。
②钠离子通道阻断剂:主要包括卡马西平和奥卡西平,是治疗三叉神经痛的一线用药 [15]。因在其余类型的NP中疗效不确定,所以不作为一线推荐 [15]。
(2)抗抑郁药:
①三环类抗抑郁药 (TCAs):最常用的为阿米替林、去甲替林,可作用于疼痛传导通路的多个环节:阻断多种离子通道,抑制5-羟色胺和去甲肾上腺素的再摄取,主要在疼痛传导途径中的下行抑制通路发挥作用。使用阿米替林时应注意其心脏毒性 [15]。
② 5-羟色胺、去甲肾上腺素再摄取抑制药 (SNRIs):常用药物有文拉法辛和度洛西汀等。该类药物选择性抑制5-羟色胺、去甲肾上腺素再摄取,提高二者在突触间隙的浓度,在疼痛传导途径中的下行通路发挥作用 [15]。
(3)局部用药:
①利多卡因:利多卡因是电压门控钠通道阻断剂,通过阻断神经损伤后异常表达的钠离子通道Nav 1.8 和Nav 1.7,减少周围神经的异常放电,降低外周敏化 [36],是带状疱疹相关神经痛的一线用药,也用于治疗糖尿病性NP、艾滋病相关性NP [36~38]。
②辣椒素:辣椒素是通过与位于Aδ 纤维和C 纤维上的TRPV1 受体结合而发挥作用,其与受体结合后引起P 物质释放,并通过钠离子和钙离子内流导致短暂的去极化。长时间接触辣椒素会过度刺激其受体并使其脱敏,从而导致其功能失活。局部辣椒素的镇痛作用可以解释为可逆性的神经变性 [36]。高浓度辣椒素(8%) 常作为局部NP 的一线用药,也可用于治疗HIV-DSP、PHN、PDPN、颈腰椎相关的NP [36~38]。
(4)曲马多:曲马多具有双重作用机制,可同时作用于μ 阿片受体和去甲肾上腺素/5-羟色胺受体以达到镇痛效果。不良反应与剂量相关,虽滥用率低,但也会发生身体依赖,需逐步停药 [15]。
(5)阿片类镇痛药:可单独使用,或与一线药联合使用,常用药物有吗啡、羟考酮和芬太尼等。速释剂型用于爆发痛,缓释剂型用于慢性疼痛的长期治疗。未用过阿片药的病人起始量应从小剂量开始,个体量化。阿片类药物的不良反应在用药后1~2周内可能发生耐受,但便秘终身不耐受,需要加以防治。一旦NP 病因去除或调控治疗有效缓解疼痛后,应缓慢减少药量至撤除用药 [15]。
(6)其他药物:除上述药物外,一些药物在临床已有广泛应用,包括牛痘疫苗接种家兔皮肤炎症提取物、10% 氯胺酮贴剂、0.1% 可乐定贴剂、5%巴氯芬贴剂、丁丙诺啡透皮贴、A 型肉毒素、草乌甲素、美金刚、美西律以及某些抗惊厥药(拉莫三嗪、丙戊酸钠、托吡酯等)[15,39]。
3. 微创介入治疗
(1)神经毁损:分为化学毁损和物理毁损两种方式,操作方法相类似。都是在影像引导下定位穿刺到需要治疗的神经周围,通过物理(主要是射频热凝)或化学(神经破坏药物)的方法阻断痛觉传导。毁损的方法虽然取得了一定的疗效(如三叉神经痛),但无论使用哪一种毁损方法,都应尽量避免损坏病人的生活机能,保障治疗安全。
(2)射频调控:脉冲射频是近些年发展起来的一种治疗或改善周围神经病变的一种介入手段,其机制为脉冲射频激发疼痛信号传入通路的可塑性改变,产生疼痛的抑制作用。使用2 Hz、20 ms 的脉冲式射频电流,产生的温度低于42℃,对神经纤维解剖结构无破坏作用 [15]。脉冲射频(pulsed radio frequency, PRF) 可以减轻神经损伤后的NP [28]。PRF对脊柱疾病引起的根性疼痛、带状疱疹后神经痛、枕神经痛有效 [27,42~44];治疗三叉神经痛的持续时间较短,疗效比射频热凝术弱,但安全性优于传统射频治疗 [43,44]。脉冲射频有两种治疗模式一种是标准脉冲模式,另一种是手动脉冲模式,手动模式时各治疗参数均可调节,主要是控制温度,避免神经感觉传导受到不可逆的损伤。
(3)神经阻滞:神经阻滞是NP 的常用治疗方法 [15],用于带状疱疹后神经痛,II 型复杂区域疼痛综合征(complex regional pain syndrome, CRPS)、痛性糖尿病周围神经病变以及创伤性和手术性神经损伤 [45]。
目前得到广泛认可的神经阻滞治疗用药包括局部麻醉药、糖皮质激素、阿片类药物、神经毁损药等[15]。神经阻滞应做好充分的病人病情评估,把握适应证,熟悉阻滞部位的解剖结构以及阻滞用药的作用机制、不良反应和联合用药的利弊,规范穿刺及操作技术,准确进行效果评价,了解可能的并发症并采取相应预防措施 [15]。
4. 神经调控治疗
神经电刺激术是近十多年来逐渐得到广泛认可和专业推崇的微创外科镇痛术式,通过体内植入刺激电极和脉冲发生器,采用电刺激的形式对疼痛感觉的传导、呈递、形成等环节进行调制,达到减轻或消除疼痛的效果。神经电刺激术不仅具有手术微创的优点,不破坏神经,而且还具有可程控、可测试、可逆转等优点。
(1)外周神经电刺激 (peripheral nerve stimulation, PNS):PNS 的镇痛机理与闸门控制机制激活有关,刺激外周神经纤维抑制了C 纤维的活性,从而降低了脊髓后角神经元对伤害性刺激的反应。此外,还发现PNS 影响了由5-羟色胺、脑腓肽、γ-氨基丁酸和谷氨酸等介导的脊髓下行调制系统。PNS 主要适用于单个外周神经损伤或病变所致的慢性顽固性疼痛,疼痛应局限于某根外周神经支配的区域,如外伤、复杂性区域疼痛综合征、枕神经痛、带状疱疹后神经痛等 [46~49]。部分偏头痛病人适合枕神经刺激治疗。
PNS 常选择刺激的外周神经有枕神经、脊神经背根、尺神经、正中神经、桡神经、胫后神经、腓总神经等。在植入电极时,应将电极植入神经损伤部位的近端。若使用穿刺电极,应在皮下脂肪内穿刺置入电极,使电极与所刺激的神经相交叉。
(2)脊髓电刺激 (spinal cord stimulation, SCS):SCS 是将刺激电极植入脊髓硬膜外腔,通过电流刺激脊髓后柱的传导束和后角感觉神经元达到镇痛的效果[50]。镇痛的主要理论依据是疼痛的闸门控制学说,低电流刺激脊髓背柱可以活化疼痛抑制神经纤维,关闭疼痛信息的传递,进而缓解和阻断疼痛感觉 [50]。
SCS 主要适用于腰椎术后疼痛综合征、复杂性区域疼痛综合征、周围神经损伤后疼痛或pNP、交感神经功能失调和周围缺血性病变引起的疼痛、带状疱疹后神经痛、残肢痛、功能性心绞痛等 [50~52]。SCS 电极包括经皮穿刺针状电极和外科植入片状电极,穿刺电极又分为测试电极和植入电极,前者用于临床筛选试验,不能永久植入;后者可永久植入。穿刺电极的优点是易于植入,通过经皮穿刺硬膜外腔即可植入,操作简单,但是较易移位,且耗电量高。外科电极需要通过切开部分椎板进行植入,操作过程相对复杂,优点是不易移位,耗电量低。术者可根据病人的疼痛范围选择不同型号的电极,外科电极可选择的长短、宽窄、触点数量和触点组合模式更多,可以达到更为精确的镇痛覆盖范围。根据疼痛的部位确定电极植入的脊髓节段,如下肢疼痛电极置于T10-L1,心绞痛电极置于T1-2 脊髓中线或左侧,上肢疼痛电极置于C4-7,头颈部疼痛电极置于C1-2。单侧疼痛者,电极置于同侧;双侧疼痛者,可将2 根电极并列置于两侧或选择双排或三排电极。植入电极之后,应连接测试用延长导线,进行试验性SCS 治疗1~2 周,观察评估镇痛疗效。如果测试效果满意,二期手术植入永久性刺激脉冲发生器。如果测试效果不满意,可以二期手术取出刺激电极。
SCS 的并发症包括与手术相关和机械相关的并发症,总发生率约为5%~10%。与手术相关的并发症有脊髓损伤、脑脊液漏、感染、排异反应等;与机械相关的并发症有电极移位、电极断裂、失连接、刺激器工作不正常等[50~52]。其中并发症中最常见的是电极移位,其次是局部感染[50]。
(3)鞘内药物输注系统:鞘内药物输注系统是通过埋藏在病人体内的药物输注泵,将泵内的药物输注到病人的蛛网膜下隙,作用于脊髓或中枢相应的位点,阻断疼痛信号向中枢传递,使疼痛信号无法达到大脑皮层,从而达到控制疼痛的目的[15],适用于保守治疗失败的躯干四肢疼痛以及顽固性疼痛,包括带状疱疹后神经痛、开胸术后疼痛、化疗相关的癌痛、复杂性区域疼痛综合征等 [53,54]。
国内常见的鞘内泵配置的药物包括阿片类药物、局部麻醉药、钙通道阻滞剂、α2 受体激动剂及NMDA 受体拮抗剂等,其中吗啡的临床应用最广,被视为一线药物 [15]。常用于连续注射的吗啡剂量的预试验(剂量滴定),一般初次剂量从胃肠外剂量的1% 开始,根据镇痛效果与病人一般情况逐渐调整,以达到最好的镇痛效果和最小的不良反应 [15]。
5. 手术治疗
手术治疗的方式主要为周围神经减压术,早期用于周围神经卡压,Dellon 率先应用周围神经减压术治疗糖尿病性周围神经病变,取得良好的疗效[55]。Dellon 经过大量的动物试验和人的尸体解剖后,提出正常人的周围神经在穿过肌腱、韧带、肌筋膜处存在多处生理性解剖狭窄;由于糖尿病病人的多元醇代谢通路紊乱,使大量果糖蓄积在周围神经细胞内,渗透压增高,水被汲入神经细胞内,导致神经水肿,在这些生理性解剖狭窄处就会出现神经嵌压,从而产生症状 [56]。他认为糖尿病性周围神经病变是由代谢异常和周围神经嵌压双重因素所致,因此,周围神经减压可以改善病人的症状,改变糖尿病性周围神经病变的自然病程 [56]。许多学者经过大量的临床实践后报道周围神经减压术可使80%~90% 的糖尿病性周围神经病变病人疼痛缓解,感觉改善 [57,58],越早治疗,术后功能恢复越好。在一项对50 例单侧手术病人长期随访的研究中,发现术侧肢体无1 例出现溃疡和截肢,而非手术侧肢体有12 例出现溃疡,3 例已接受截肢,提示周围神经减压术可改变糖尿病性周围神经病变的自然病程,减少溃疡和截肢的发生率 [59]。
6. 其他治疗
pNP 诊疗的主要目标是发现潜在原因,明确诊断,消除危险因素,减轻疼痛。在诊疗计划中,除药物疗法、介入性治疗外,需要将物理疗法、康复治疗、行为认知治疗、心理治疗等列入考虑范围,提高治疗成功率 [60]。
中国医师协会疼痛科医师分会、
国家临床重点专科·中日医院疼痛专科医联体
北京市疼痛治疗质量控制改进中心
周围神经病理性疼痛中国专家共识编委会名单:
朱 谦 樊碧发 张达颖 于生元 傅志俭 吕 岩 李荣春 熊东林 陶 蔚 万 丽
王祥瑞 李艳华 刘 慧 魏 俊 李水清 孙永海 胡永生 吴大胜 周 伶
△ 通讯作者 樊碧发15010101616@yeah.net
文章来源:《中国疼痛医学杂志》2020年第26卷第5期,指南与规范栏目《周围神经病理性疼痛中国专家共识》第321-328页。