文 章 信 息
国家放射与治疗临床医学研究中心,苏州工业园区东方华夏心血管健康研究院高血压介入治疗工作委员会,《经皮去肾神经术治疗高血压临床路径中国专家共识(2025版)》专家组. 经皮去肾神经术治疗高血压临床路径中国专家共识(2025版)[J]. 中国介入心脏病学杂志,2025,33(9):481-490.
DOI:10.3969/j.issn.1004-8812.2025.09.001.
通信作者:
周玉杰,
Email:azzyj12@163.com;
孙宁玲,
Email:sunnl@263.net;
王伟民,
Email:weiminwang@vip.sina.com;
葛均波,
Email:ge.junbo@zs-hospital.sh.cn
交感神经过度激活是原发性高血压发生、发展和维持的重要原因之一。近年来,高血压的介入手术备受关注,并成为一种治疗方式逐渐走进临床。其中经皮去肾神经术(renal denervation,RDN)是经多项随机假手术对照临床研究验证的方法,目前已被多数国家的指南或专家共识推荐作为降压药物难以控制的高血压可选择治疗手段之一。国家药品监督管理局(National Medical Products Administration,NMPA)已经批准数个RDN器械用于难治性高血压或不耐受降压药物的高血压患者的治疗。鉴于目前在我国获批的RDN器械设计各有特色,手术术式也有差异,为了推动这项技术有序开展,规范操作流程和诊疗行为,我国心血管介入领域和高血压领域从事和关注RDN研究的专家们结合目前的国内外指南、共识、科学声明及临床实践经验,共同协商,与时俱进,制订RDN治疗高血压临床路径中国专家共识,供临床参考。
1 RDN患者的临床评估
在决定进行RDN手术前,应对患者的适应证和禁忌证、继发性高血压、肾功能、肾动脉以及沿途血管解剖等进行充分评估,并对患者进行充分的知情同意,充分告知RDN可能的获益和风险以及目前的局限性等。开展RDN治疗的中心应能够对高血压患者进行诊断、鉴别诊断和规范治疗,有介入性血管治疗能力。可组成包括心内科、血管介入科、内分泌科、肾脏科、泌尿外科、血管外科和麻醉科等的多学科团队,共同协商决策,优化患者治疗选择以及管理。
1. 1 RDN的适应证和禁忌证
(1)适应证。根据目前国内外研究结果及指南共识,推荐以下患者可以考虑RDN治疗。
①难治性高血压:在生活方式干预基础上,规律服用包含利尿剂在内的≥3种不同种类降压药物至少1个月,且每种药物为最大剂量或最大耐受剂量,血压仍未有效控制,诊室血压(office blood pressure,OBP)≥140/90 mmHg(1 mmHg=0.133 kPa),同时24 h动态收缩压(24-hour ambulatory systolic blood pressure,24 h ASBP)≥130 mmHg或者日间平均收缩压≥135 mmHg,或者服用≥4种降压药物血压才能达标。
②药物控制不佳的高血压:在生活方式干预基础上,使用2种及2种以上合理剂量的降压药物规范治疗1个月后,血压仍未控制(OBP≥150/90 mmHg和24 h ASBP≥135 mmHg)。
③降压药物不耐受和服药依从性差,导致血压未得到有效控制的高血压患者。
(2)禁忌证。基于现有的循证医学证据,目前RDN的禁忌证包括如下情况。
①单侧或双侧肾动脉形态结构不适宜手术(例如肾动脉狭窄>50%、肾动脉瘤、肾动脉畸形、肾动脉纤维肌发育不良等)。
②肾移植。
③6个月内有心血管事件(不稳定型心绞痛、心肌梗死)、脑血管事件(脑卒中、短暂性脑缺血发作)。
④年龄<18岁、孕妇。
⑤估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)≤40 ml/(min · 1.73 m2)。
⑥严重肝功能不全。
⑦未经治疗的继发性高血压。
⑧其他介入治疗的禁忌证等。
1. 2 患者筛选
1. 2. 1 确定血压水平 在筛选是否适合接受RDN治疗的患者时,血压测量的准确性至关重要。单一方式的血压测量往往无法获取真实的血压情况,必须将OBP、动态血压(ambulatory blood pressure,ABP)和家庭血压(home blood pressure,HBP)等多项数据结合进行综合评估。血压水平应通过标准化的测量程序进行,并综合多次测量的结果,以确保诊断的准确性。
(1)诊室血压测量(office blood pressure measurement,OBPM)
患者应在安静、舒适的环境中,坐位休息至少5 min;患者的上臂应置于心脏水平,同时肘部应放在桌面上,选择合适大小的袖带。推荐至少进行2次测量,间隔30~60 s,计算2次读数平均值,若两次读数相差10 mmHg以上,应进行第3次测量,并取2~3次读数的平均值。
OBPM是最常用的高血压评估方法,但容易受到外部因素的影响,如患者紧张、环境改变等。OBPM包括医护人员进行的常规OBPM以及患者自我操作的自动诊室血压测量(automated office blood pressure measurement,AOBP)。在筛选适合RDN治疗的患者时推荐使用AOBP,可以在一定程度上减少白大衣效应。
(2)诊室外血压测量
①家庭血压监测(home blood pressure monitoring,HBPM):HBPM是患者日常监测血压的重要手段,能够避免诊室效应,并为医师提供患者在自然生活状态下的血压数据。HBPM是对患者血压波动进行连续评估的有效工具,在判断治疗效果、提升高血压控制率等方面具有重要意义。HBPM推荐在安静、舒适的环境中进行,使用合适的血压计进行测量。患者应在清晨起床后排空膀胱、服药前和早饭前坐位测量血压, 晚上在晚饭后、洗漱后、睡觉前测量血压。连续记录5~7 d,早晚各测量2~3个读数,计算平均值。
②动态血压监测(ambulatory blood pressure monitoring,ABPM): ABPM能够提供全天候血压波动数据,避免了单次诊室血压测量可能带来的偶然误差。能够有效地发现白大衣高血压和隐蔽性高血压,准确记录血压的昼夜变化。为了确保测量的准确性,ABPM设备应经过校准,且患者应遵循医嘱,保持正常日常活动,以保证血压数据可代表日常活动状态下的血压水平。患者在佩戴监测设备时应尽量避免过度运动或情绪波动等因素的干扰。
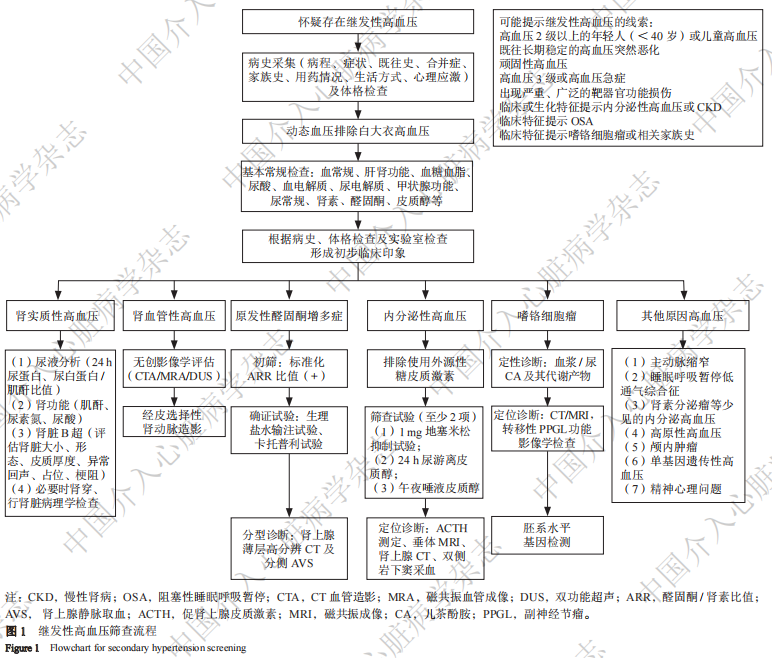
1. 2. 2 筛查继发性高血压 继发性高血压在高血压患者中约占10%,在难治性高血压患者中比例明显增高,可达20%~35%。继发性高血压是其他疾病或病理生理状态导致的高血压,涉及肾及肾血管、内分泌、睡眠呼吸、自身免疫、神经、血液等多个系统的多种疾病以及药物、机械血流障碍、单基因突变等病理生理状态。治疗原发疾病后,血压往往可以明显改善、甚至得到控制。筛选适合的RDN患者时应排除未经治疗的继发性高血压,筛查流程见图1并参见《中国继发性高血压临床筛查多学科专家共识(2023)》及《内分泌性高血压筛查专家共识(2025版)》。
1. 2. 3 实验室检查 RDN术前常规的实验室检查,可以明确肾功能和内环境的稳态,对于患者筛选和保证手术的安全有重要作用。
(1)肾功能评估:RDN术前,应进行血清肌酐(serum creatinine,Scr)并eGFR检测,用于评估基础肾功能,确保患者肾功能符合手术条件。同时检测尿常规、尿蛋白定量和蛋白尿或白蛋白/肌酐比值,排除潜在的肾脏器质性病变。
(2)电解质与代谢指标:评估电解质尤其是血钾、血钠、血钙平衡非常重要,可以确保手术安全性,同时避免因RDN影响肾脏水盐代谢调节能力。血脂、尿酸、空腹血糖及糖化血红蛋白(HbA1c)可用于高血压合并症的评估。
(3)其他相关指标:术前血常规、肝功能、凝血功能,与其他介入手术相同,主要确保患者无手术禁忌证和手术安全性。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)检测,可用于评估RAAS激活状态,也可以间接反映交感神经激活程度;血浆去甲肾上腺素水平也能够间接反映交感神经活性;24 h尿电解质,了解尿钠和尿钾及容量情况,部分研究将其作为术前筛选指标,在有条件的单位可以考虑检测。
1. 2. 4 肾动脉影像学评估 清晰准确的肾动脉影像学评估是RDN操作成功的解剖学基础和选择适宜RDN导管及血管入路的客观依据。理想的RDN操作所需肾动脉影像学评估应包括以下方面。
(1)清晰显示肾动脉主支及所有副肾动脉,可以测量管腔直径和长度,了解是否存在显著狭窄、夹层、钙化、动脉瘤等RDN禁忌病变。
(2)清晰显示肾动脉主干及一级分支的形态,了解RDN导管操作难度。
(3)测量肾动脉主干与腹主动脉的夹角大小,便于选择介入操作的合适入路。
(4)清晰显示肾下腹主动脉及髂股动脉全貌,了解是否存在显著狭窄和(或)迂曲,判断股动脉入路是否可行。
(5)清晰显示锁骨下动脉、主动脉弓、胸主动脉全貌,了解主动脉弓型以及是否存在显著狭窄和(或)迂曲,判断上肢动脉入路是否可行。
(6)了解肾脏、肾上腺、肾盂和输尿管是否存在解剖异常或病变。
要满足以上6项评估要求,全主动脉CT血管造影(CT angiography,CTA)是首选,磁共振血管成像(magnetic resonance arteriography,MRA)次之,有创主动脉造影和肾动脉选择性造影一般仅用于RDN操作时。双功能超声难以满足以上6项评估,但可用于初筛。
1. 2. 5 医患共同决策 RDN是一种新的高血压治疗手段,然而其适应人群筛选较为复杂,涉及患者的血压控制是否达标、生活方式改善是否充分、药物治疗的反应和耐受性、个体差异及合并症等多方面的因素。同时,大约有30%的患者对RDN治疗反应不佳或者无反应,目前尚缺乏有效的方法来预测对RDN治疗的反应性。此外,虽然目前RDN的长期疗效和安全性已得到一些研究的支持,但对主要心血管事件发生率、死亡率等临床硬终点的获益尚需进一步的数据证实。详细解释治疗的可能获益和不确定性,使患者建立合理的治疗预期,将有助于患者做出更为理性的选择,减少因期望值过高导致的医患矛盾。因此,医患共同决策就显得尤为重要。在共同决策过程中,通过详细说明RDN的治疗流程,包括术前评估、适应证及禁忌证、手术风险、操作过程、术后恢复、随访要点等各个环节,使患者消除对RDN技术的不安和疑虑、建立对治疗的信任,从而提高患者对RDN治疗的理解与依从性,减少决策冲突并降低医疗纠纷风险。
2 RDN规范化操作流程
2. 1 场地及手术设备要求
RDN手术对导管室场地的要求与其他血管介入手术场地基本一致,应有符合相关标准的空气净化装置和放射防护设施,并能支持多学科团队操作。各中心应根据医院条件、患者术前评估和拟采用的消融方式,在手术室准备好手术所需器械。手术室应配备必要的急救设备,包括心脏电除颤器、呼吸机和急救药品等。必须有血管修复工具及材料,以应对术中可能发生的血管损伤或其他突发状况。
2. 2 术前准备
2. 2. 1 术前药物准备 尽管目前临床证据显示RDN手术安全性良好,术后急性肾损伤和肾功能恶化的发生率极低。但是由于RDN术中对比剂直接在肾动脉内注射,为降低可能发生的对比剂肾病风险,建议围术期停用可能影响肾功能的药物,包括但不限于二甲双胍、非甾体类抗炎药等;对于有潜在肾功能损伤的患者,应给予充分水化,并尽量减少对比剂的用量。
RDN围术期抗血小板和抗凝策略,目前没有相应临床研究支持,证据尚不充分,主要借鉴RDN临床研究方案和指南及共识推荐。术前未服用抗血小板药物的患者,如无禁忌证,建议术前1 d启动单药抗血小板治疗(阿司匹林100 mg、每日1次或氯吡格雷75 mg、每日1次),无需给予负荷剂量,并在术后维持4周。如合并其他疾病,则按相关疾病指南决定抗血小板药物的剂量与时间。对于接受口服抗凝药物治疗的患者,术前可不停用抗凝药物。术中根据活化凝血时间(activated clotting time,ACT)调整肝素用量,维持ACT在250~300 s。
为确保手术安全进行,术者可根据患者术前、术中血压情况,合理应用静脉药物控制血压,如血压过高可以应用硝普纳、乌拉地尔、硝酸甘油、酚妥拉明等。为预防消融中的肾动脉痉挛,消融前可根据血压的情况给予硝酸甘油。
2. 2. 2 镇痛、镇静的评估及选择 RDN消融过程中产生的热传导刺激会通过传入神经导致明显的内脏痛,这种疼痛会增加患者的恐惧、焦虑,不仅影响患者的舒适度,由于疼痛所致的体位突然变动会直接影响手术操作的安全性。因此充分的镇痛、镇静是成功进行RDN手术的重要组成部分。
(1)清醒镇静(conscious sedation):通过术前谈话表明可以很好配合RDN手术,美国麻醉师协会(American Society of Anesthesiologists,ASA)麻醉分级Ⅱ级以上的患者,可使用小剂量的阿片类药物(例如吗啡、芬太尼、舒芬太尼),必要时可增加苯二氮类镇静药物(例如咪达唑仑等),可以很好地满足RDN手术操作需求,但是需要考虑阿片类药物潜在的呼吸抑制风险。术前30~60 min使用非甾体类抗炎药,如口服对乙酰氨基酚,静脉注射氟比洛芬酯,可以减轻术后炎性疼痛且不增加呼吸抑制的风险。但是需要注意非甾体类抗炎药可能会增加对比剂肾病的风险,对肾功能受损患者尽量避免使用。
(2)深度镇静(deep sedation):静脉给予短效镇静药物(例如丙泊酚、右美托咪定)和超短效镇痛药物(如瑞芬太尼)联合应用,能够使患者平静、配合和保持不动,且具有良好的可控性,能够维持良好的自主呼吸和血流动力学稳定。对于不能很好配合手术操作,如合并神经系统疾病(帕金森病等)、病态肥胖、睡眠呼吸暂停、难以控制体动的焦虑患者可以选择全身麻醉,必要时可使用喉罩配合机械通气完成手术,临床镇静目标是完成RDN治疗后即可以清醒回到病房。
对于合并左心功能不全、肾功能不全等存在血流动力学潜在波动风险的患者,需要心内科医师、血管介入科医师、麻醉科医师等多学科团队进一步评估,选择适当的镇痛、镇静方案完成治疗。
2. 3 手术操作流程
2. 3. 1 手术器械及物品准备
RDN手术所需耗材包括血管鞘、导丝、指引导管、消融导管和射频发生器、血管缝合器/血管封堵器等。
2. 3. 2 手术流程
(1)一般准备:将负极板/分散电极板贴在大腿侧边或臀部(如有必要,贴片区域备皮以确保良好接触),另一端连接到射频发生器。确保术中实时有创压力监测、心电监护及血氧饱和度监测。
(2)镇痛及药物准备:开放静脉通路,确保患者在手术期间可以接受静脉给药。术前连接好镇痛镇静泵,并于穿刺前10 min根据预定镇痛、镇静方案给药。
(3)穿刺:穿刺点局部麻醉后,采用改良Seldinger置管技术,经股动脉或桡动脉插入血管鞘,动脉内给予普通肝素,维持ACT在250~300 s。
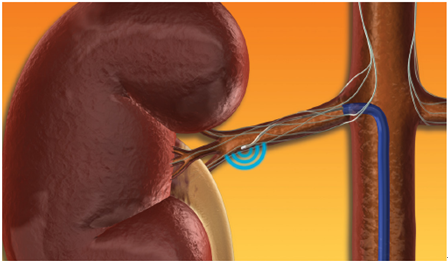
(4)肾动脉造影:在导丝引导下推送指引导管至腹主动脉第1腰椎水平,排气建立动脉内压力监测后将指引导管超选至肾动脉,用指引导管行肾动脉造影了解肾动脉及分支情况,确定需要消融的动脉。初学者,如果对腹主动脉及其分支解剖不熟悉,可先行非选择性造影,以了解肾动脉大致位置,然后再行选择性肾动脉造影。根据肾动脉与腹主动脉成角及肾动脉解剖特征选择合适的指引导管和消融导管。
(5)消融:现有的RDN导管设计各有不同,操作流程上也有差异,可分为导丝介导消融、非导丝介导消融及标测消融3种类型。①导丝介导消融,先送入导引导丝和指引导管至靶肾动脉开口,导丝进入拟消融血管远端,消融导管沿导引导丝进入靶血管,递送至拟消融部位,后撤导引导丝,观察射频发生器上显示的消融电极的阻抗情况,如不理想可适当地旋转导管改善电极贴壁,阻抗稳定后进行消融。②非导丝介导消融,消融导管通过指引导管进入肾动脉。确定消融位置后,手动调控消融电极贴壁。通过小功率测试确定电极贴壁良好(温度逐渐上升和阻抗稳定),手动关闭贴壁不佳电极后进行消融。到目前为止,还未见有效的、易于应用的临床指标表明即刻消融成功,目前大多数观点建议采用“应消尽消”的治疗策略。消融中,无论导丝介导还是非导丝介导的消融均建议由肾动脉远端至近端逐步消融,直径3~8 mm之间的肾动脉主干、分支及副肾动脉,在导管可及的情况下都应该考虑消融,消融应覆盖血管的四个象限。通过消融中实时监测电极的温度和阻抗反馈确保消融的有效性。③标测消融,通过消融电极刺激肾动脉内膜,观察患者血压变化来确定是热点(收缩压升高≥5 mmHg以上)、中性点(收缩压变化<5 mmHg)及冷点(收缩压下降≥5 mmHg以上),对热点进行消融。消融后,在消融位点重复电刺激进行验证。血压不再发生变化或者升高幅度显著减少(与消融前相比<50%),可判断该点实施了有效的消融,若血压仍明显升高,建议进行再次消融。每个点位最多消融2次,不建议3次及以上的消融。该导管仅在肾动脉主干消融。
为达到有效毁损肾交感神经的目的,要求有效消融点的温度/功率、阻抗和消融时间需符合导管的设定标准。各消融导管的详细操作流程、术中参数及注意事项,以各导管产品说明书为准。
完成双侧经肾动脉交感神经消融后,再次进行左右肾动脉造影,排除肾及肾血管损伤。
2. 4 术后管理
(1)血管入路管理:消融结束后,拔除鞘管。对于经股动脉入路患者,建议血管缝合器/血管封堵器闭合穿刺点。若不适用血管缝合器/血管封堵器,建议保留鞘管3~4 h后再予以拔除,徒手压迫10~15 min后加压包扎。根据是否进行了血管缝合器/血管封堵器决定下肢制动时间,建议制动12~24 h。对于经桡动脉等上肢动脉血管入路的患者,建议术后压迫6 h,期间逐步放松压迫力度。定期观察穿刺部位出血、血肿以及肢体末梢的血供情况。为避免静脉血栓栓塞的发生,不建议患者术后长时间绝对卧床和制动。
(2)监测生命体征:RDN术后常规至少监测生命体征24 h,尤其是血压和心率变化情况。当患者突然出现血压明显下降时,应第一时间检查穿刺部位及入路血管有无出血和血肿,并给予相应的处理。当患者出现血压降低,伴有心率减慢、面色苍白、出冷汗等症状时要考虑发生血管迷走神经反射的可能性,应及时静脉注射阿托品、补液或升压等处理,并消除患者的紧张情绪。如果血管迷走神经反射是由术后疼痛所致,可考虑适当使用镇静和镇痛治疗。
2. 5 常见并发症及处理
RDN相关并发症包括肾血管并发症、血管穿刺部位并发症和肾脏并发症。
2. 5. 1 肾血管并发症 多与手术操作相关,主要包括肾动脉狭窄、闭塞、夹层、血栓、穿孔等,发生率一般低于1%,往往与术者经验有关。
(1)肾动脉穿孔,主要为导丝和导管操作不当所致。肾动脉造影时可见对比剂从穿孔处溢出,在肾实质内呈烟雾状潴留。出血量较大时患者表现为腰腹部严重疼痛,甚至出现失血性休克表现。超声可见肾周大量积液。如破口小、出血程度轻,可用球囊反复堵塞穿孔的肾动脉几次(3~5分钟/次)并注射鱼精蛋白中和肝素,往往有效。如果此方法无效,可行选择性动脉栓塞术。
(2)肾动脉血栓形成,消融可能导致肾动脉内膜损伤,血栓形成,表现为消融部位可见附壁血栓影,严重时导致血管狭窄,限制血流通过。肾动脉血栓在RDN术中罕见,多出现于术后,表现为腰疼、血尿。肾动脉CTA或MRA可作出诊断。可使用静脉溶栓,严重血栓需要急诊介入开通血管。
(3)肾动脉夹层,往往由于操作粗暴所致,如发现操作部位有撕裂的内膜片,并明显限制血流,需留置导丝在远端真腔内予以置入支架治疗,使内膜贴壁,恢复血流。
(4)肾动脉痉挛,往往由于操作中电极贴壁不良、导管阻挡血流或治疗血管内径偏小、阻抗过大所致,如发现射频部位阻抗和温度急剧上升并自动中断电流,患者伴明显腹痛,要立刻造影观察。如发现消融部位肾动脉明显收缩或血流无法通过,表明已发生肾动脉痉挛,需尽快留置导丝至血管远端,把射频导管退出阻塞部位,经指引导管推注硝酸甘油100~200 μg入肾动脉,可重复1~2次,造影观察阻塞是否解除。如收缩直径仍大于50%,建议行球囊扩张,球囊直径与正常参考血管等大或小10%。必要时也可考虑置入支架。
术中操作轻柔是预防肾血管并发症的关键,术中、术后应密切观察早发现早处理。
2. 5. 2 血管穿刺部位并发症 包括穿刺部位血肿、假动脉瘤、动静脉瘘等。处理方法与其他介入血管并发症相同。有条件的单位可以在超声引导下穿刺股动脉减少血管并发症。
2. 5. 3 肾脏并发症 主要为急性肾损伤(acute kidney injury,AKI)。术前筛查、术后监测肾功能,对于高风险患者,术前术后水化和限制对比剂用量,可以减少AKI发生。大部分患者经过治疗后可恢复,极少部分患者肾功能出现不可逆的损伤,甚至需要终生透析。
3 RDN术后随访
3. 1 血压随访评估和术后药物管理
RDN术后的血压评估是非常重要的环节,用于监测患者的手术效果及长期心血管健康管理。血压评估包括以下2个方面。(1)规范的术后血压监测:推荐成人采用经过标准化方案验证的上臂式电子血压计测量血压、采用规范正确的测量方法测量血压。术后应依据OBPM、ABPM或HBPM定期进行血压评估,有条件也可以应用能实时上传数据的血压设备。(2)定期的术后随访:推荐术后进行HBPM。有条件的情况下,建议每月复查OBPM,术后半年复查ABPM,并建议长期随访。
虽然有多项研究数据显示,约30%~40%的患者在术后6个月或3年内减少了至少1种降压药物,药物负荷指数也显著降低,但是RDN治疗后大部分患者仍需继续服用降压药物以维持血压达标。建议RDN术后降压药物管理根据患者的血压控制情况调整,对于心血管病高风险或有并发症患者,药物调整应同时兼顾动脉粥样硬化性心血管病(atherosclerotic cardiovascular disease,ASCVD)的治疗,遵循《中国高血压防治指南(2024修订版)》的推荐,遵循个体化原则,确保血压达标。
3. 2 肾动脉影像学随访评估
RDN术后随访肾动脉影像学很有必要。RDN刚开始用于临床,为了解其安全性和可能的操作并发症,建议在术后3个月或6个月时做肾动脉超声检查,在6个月或12个月时做肾动脉CTA检查,以后每年做1次超声检查。有以下情况时需尽早进行影像学复查:(1)降压药不变的情况下血压不降反升;(2)肾功能进行性下降;(3)一侧肾脏明显萎缩。
3. 3 肾功能随访评估
RDN术后肾功能随访的研究大多来自RDN降压为一级终点的临床试验,79%的事件发生在术后1年内。因此,建议RDN术后肾功能早期随访评估时间为术后1周,重点排除对比剂肾病。之后1、3、6、12个月随访,重点关注肾功能变化,包括eGFR、Scr等。术后1年及以上的评估则应重点关注严重肾功能衰竭[eGFR<15 ml/(min · 1.73 m2)或需要替代治疗]。随访内容应包括临床表现(如水肿、尿的变化等)、实验室检查(Scr、eGFR、尿白蛋白/肌酐等) 。
3. 4 主要临床事件随访
目前RDN临床疗效评价主要观察指标是血压,缺乏严格设计的随机对照临床研究反映其对临床事件的影响。现有较大样本、较长时间观察的是Global SYMPLICITY Registry(GSR)研究。通过该队列研究获得了一些对RDN降低临床事件的认识,包括心肌梗死、脑卒中、心血管死亡和全因死亡、肾动脉介入、血管并发症、新发心力衰竭住院、心房颤动、高血压危象、肢体严重缺血和肾功能衰竭等与患者高血压状态维持可能发生的事件相比有所下降。但是,因为缺乏假手术组,这些通过RDN术后血压反应和模型预测的临床事件减少难以准确反映RDN治疗对内在的自主神经状态改变的综合效应。
对于RDN术后主要临床事件的随访,应包括RDN诊疗过程相关的有效性和安全性结果。既包括非致死性脑卒中、非致死性心肌梗死和心血管死亡,也包括维度更大的全因死亡,外周血管缺血事件、肾功能的减损及终末期肾病发生率的变化、远期靶血管、血管入路和全身血管的影响等。直立性低血压和跌倒晕厥、内脏自主神经的功能状态也值得关注。此外,由于RDN技术的多元性和治疗程序的复杂性,特定技术的安全性、有效性和长期临床获益应有差别评价。对于交感高活性患者,降压外的临床获益也是特别值得关注和期待的领域,如RDN对心力衰竭、心律失常、睡眠呼吸暂停低通气综合征、多囊卵巢综合征、糖尿病、代谢性疾病以及系统性炎症等疾病和病理状态的发生发展和治疗的效应均应长期进行观察随访。
未来一段时间RDN治疗后血压变化依然会成为主要替代终点,病例的不断积累将为其临床作用的全面评估提供基础。因此建立科学全面的随访体系,通过人工智能技术进行科学和全面的随访,进行深入的基础和临床研究,回答目前尚存在的问题,能更加精准地评估RDN的适应人群和治疗效果,为RDN健康有序发展提供有力支撑。
4 结语
RDN作为高血压的一种辅助治疗方法,临床研究已证实其有效性和安全性,目前可以用于多种降压药物治疗效果不佳或者不耐受降压药物且有接受RDN意愿的患者。临床路径为RDN的操作者提供了术前评估方法,术中操作流程以及术后随访要求,其目的是为了在实施RDN过程中做到全程科学、规范,让这项技术最大限度惠及广大高血压患者(图2)。

总执笔专家
李月平(首都医科大学附属北京安贞医院)
写作及审稿专家组成员(按姓氏拼音排序)
卜培莉(山东大学齐鲁医院),陈晓平(四川大学华西医院),陈韵岱(中国人民解放军总医院),冯颖青(广东省人民医院),葛均波(复旦大学附属中山医院),胡嘉禄(复旦大学附属中山医院),黄晶(重庆医科大学附属第二医院),贾楠(青岛市市立医院),蒋雄京(中国医学科学院阜外医院),孔祥清[南京医科大学第一附属医院(江苏省人民医院)],李南方(新疆维吾尔自治区人民医院),李月平(首都医科大学附属北京安贞医院),卢成志(天津市第一中心医院),马礼坤[中国科学技术大学附属第一医院(安徽省立医院)],马为(北京大学第一医院),彭勇(四川大学华西医院),苏晞(武汉亚心总医院),孙宁玲(北京大学人民医院),王成彬(首都医科大学附属北京安贞医院),王景峰(中山大学孙逸仙纪念医院),王伟民(北京大学人民医院),许建忠(上海交通大学医学院附属瑞金医院),殷跃辉(重庆医科大学附属第二医院),余静(兰州大学第二医院),张海峰(中山大学孙逸仙纪念医院),张毅(上海市第十人民医院),周玉杰(首都医科大学附属北京安贞医院)
参考文献:略
-END-
声明:本文转载于<中国介入心脏病学杂志>,以上仅代表作者本人观点,仅用于学习交流,版权归原作所有。